Determination of oxidative stress in canines in Buenos Aires City using qualitative and quantitative analytical techniques
Meneses, María Laura[1]
La Valle, Julia[2]
Recalde, Maite[3]
Resumen
Las especies reactivas de oxígeno (EROs) son productos del metabolismo celular normal, sus efectos beneficiosos se producen a concentraciones bajas e implican roles fisiológicos importantes. El efecto dañino de los radicales libres se denomina estrés oxidativo y esto ocurre en los sistemas biológicos cuando hay una sobreproducción de EROs y una deficiencia de antioxidantes enzimáticos y no enzimáticos. Los excesos de EROs pueden causar daño celular en lípidos, proteínas o ADN provocando la inhibición de su función normal y generando enfermedades tanto en el ser humano como en los animales. En el presente trabajo se intentó determinar el “estado oxidativo” de caninos clínicamente sanos y enfermos de la ciudad autónoma de Buenos Aires mediante el método cualitativo conocido CMR (capacidad metabólica residual). Asimismo se midieron las concentraciones plasmáticas de malondialdehído (MDA), tioles totales no proteicos y ácido ascórbico con la finalidad de obtener valores cuantitativos con técnicas estandarizadas y evaluarlos en conjunto con los resultados del método CMR.
En los resultados obtenidos en los tres tipos de mediciones de tipo cuantitativo se observó que no hubo diferencias significativas entre los grupos de animales sanos y enfermos, asimismo la interpretación del “estado oxidativo” de todos los valores estimados de CMR fue de desequilibrio redox en ambos grupos de animales. En conclusión, si bien la técnica de CMR posee un buen fundamento teórico y resulta muy práctico para realizar por el profesional debemos ampliar los estudios para validar esta técnica de análisis.
Palabras claves: estrés oxidativo, antioxidantes, CMR, técnicas.
Abstract
Reactive oxygen species (ROS) are products of normal cellular metabolism, their beneficial effects occur at low or moderate concentrations, and they play important physiological roles. The damaging effect of free radicals is called oxidative stress and this occurs in biological systems when there is an overproduction of ROS and a deficiency of enzymatic and non-enzymatic antioxidants. ROS excesses can cause cellular damage to lipids, proteins or DNA, causing the inhibition of their normal function and generating diseases in both humans and animals. In the present work, an attempt was made to determine the “oxidative state” of clinically healthy and diseased canines from Buenos Aires City by means of the qualitative method known as RMC (residual metabolic capacity). Plasma concentrations of malondialdehyde (MDA), total non-protein thiols and ascorbic acid were also measured in order to obtain quantitative values with standardized techniques and evaluate them together with the results of the RMC method.
In the results obtained in the three types of quantitative measurements, it was observed that there were no significant differences between the groups of healthy and sick animals, likewise the interpretation of the “oxidative state” of all the estimated values of RMC was of redox imbalance in both. animal groups. In conclusion, although the RMC technique has a good theoretical foundation and is very practical to be carried out by the professional, we must expand the studies to validate this analysis technique.
Keywords: oxidative stress, antioxidants, RMC, techniques.
Introducción
En la actualidad, se sabe que los radicales libres de oxígeno o, más en general, las especies reactivas de oxígeno (EROs), así como especies reactivas de nitrógeno (ERNs), son productos del metabolismo celular normal. EROs y ERNs son bien conocidos por jugar un papel dual, ya que pueden ser perjudiciales o beneficiosos para los sistemas vivos 25. Los efectos beneficiosos de EROs se producen a concentraciones bajas / moderadas e implican roles fisiológicos en las respuestas celulares a noxas, como ser en la defensa contra agentes infecciosos y en la función de sistemas de señalización celular. Un ejemplo beneficioso adicional de EROs en concentraciones bajas / moderadas es la inducción de una respuesta mitogénica.
El efecto dañino de los radicales libres en sistemas biológicos se denomina estrés oxidativo y estrés nitrosativo 6,15,24. Esto ocurre en los sistemas biológicos cuando hay una sobreproducción de EROs / ERNs por un lado y una deficiencia de antioxidantes enzimáticos y no enzimáticos por el otro.
Los excesos de EROs pueden causar daño celular en lípidos, proteínas o ADN provocando la inhibición de su función normal. Debido a esto, el estrés oxidativo ha sido implicado en una serie de enfermedades del ser humano y los animales, así como también en el proceso de envejecimiento.
El delicado equilibrio entre los efectos beneficiosos y perjudiciales de los radicales libres es un aspecto muy importante de los organismos vivos y se logra por mecanismos llamados “regulación redox”, apocope de reducción-oxidación.
Como citan Pérez Gastell y Pérez de Alejo13 se puede medir este tipo de “daño” mediante métodos
directos e indirectos. Entre los primeros tenemos la medición de la concentración de agentes oxidantes, que es muy difícil por su corta vida media y lo costoso que resulta el equipamiento de medición, lo que hace imprescindible analizarlos indirectamente mediante:
- Determinación de productos terminales de la acción oxidante sobre biomoléculas: los métodos para medir peróxidos lipídicos son el patrón de oro. Se basan en la reacción del tiobarbitúrico con el malondialdehído (MDA), producto este del desdoblamiento de los hidroperóxidos, formándose así un color susceptible de ser medido directamente.
- Medición de la concentración de antioxidantes: los resultados de diferentes estudios muestran que los niveles de antioxidantes pueden disminuir o aumentar en muchas enfermedades, por lo que al monitorearlos pueden ser utilizados como marcadores de enfermedad o para el seguimiento terapéutico. En este contexto, lo que se conoce como grupo tioles totales no proteicos está en relación directa con la medición del glutation reducido (GSH) debido a que es la fuente más abundante de tioles (compuestos con grupo -SH) no proteicos en las células (más del 90 %). En el estado reducido, el grupo tiol de la cisteína es capaz de donar un equivalente de reducción (H+ + e-) a otras moléculas inestables, tales como las especies reactivas de oxígeno. El ácido ascórbico también posee un efecto antioxidante porque actúa como donante de electrones reduciendo las especies reactivas de oxígeno a agua, las formas oxidadas del ascorbato son relativamente estables y no reactivas, por lo que no causan daño celular23.
- Medición del estado antioxidante total: este método refleja el balance dinámico entre el sistema antioxidante y los prooxidantes13.
En medicina veterinaria existen estudios sobre estrés oxidativo fundamentalmente en animales de producción 2,11,17. Los estudios que se observan en animales de compañía suelen estar enfocados a la medición de la capacidad oxidante y antioxidante en cáncer, como ser linfoma, para evaluar el costo-beneficio de la quimioterapia1,28.
En la actualidad, en la práctica clínica de nuestra región, no se utilizan métodos cuantitativos para la determinación de productos terminales de la acción oxidante sobre biomoléculas. Sin embargo, se está empezando a utilizar una prueba físico-química, de carácter cualitativo, para medición de la capacidad metábolica residual (CMR) que deriva de la oxidación fotobiológica. Esta técnica, consiste en exponer la sangre del paciente al H2O2 y junto con la activación electrolítica y la luz ultravioleta se produce la liberación de sustancias intracelulares. El resultado de la liberación de los radicales libres, propios de la muestra y de los añadidos, en combinación con los antioxidantes genera una reacción físico-química compleja con la formación de un sobrenadante espumoso de color y volumen variable.
Nuestro objetivo fue evaluar el ”estado oxidativo” en plasma de caninos clínicamente sanos y enfermos de la ciudad autónoma de Buenos Aires mediante el método CMR. Asimismo se medirán las concentraciones plasmáticas de malondialdehído (MDA), tioles totales no proteicos y ácido ascórbico con la finalidad de obtener valores cuantitativos para evaluarlos en conjunto con los resultados del método CMR.
Es sabido que la peroxidación lipídica como único método no debe ser utilizada como criterio universal, la evaluación del ”estado oxidativo” de un individuo puede requerir una combinación de métodos, cada uno representando diferentes tipos de ”estrés oxidativo” 4. Por lo tanto, en nuestra región este trabajo puede considerarse como el inicio de indicadores que evalúen distintos niveles de estrés oxidativo y que posterior e inevitablemente traiga aparejado la necesidad de ampliar estas mediciones.
Metodología
Se obtuvieron 5 ml de sangre entera de 29 caninos clínicamente sanos y enfermos de la Ciudad Autónoma de Buenos Aires. El criterio de elección para “animales sanos” fue que los mismos no presenten ninguna patología clínica evidente desde los 6 meses anteriores a la toma de muestra. En cuanto al grupo de “animales enfermos” se consideró a aquellos que presentaban alguna patología, sin discriminar el tipo, en el momento de la toma de muestra. De los 5 ml de sangre entera se separaron 3 ml para la medición de CMR según la siguiente metodología:
- 3 ml de sangre entera en un tubo con citrato como anticoagulante.
- A un vaso de precipitado con 10 ml de solución fisiológica y 0,4 ml de peróxido de hidrógeno se agregó la muestra de sangre.
- La muestra en el vaso con el H2O2 y la solución fisiológica de precipitado se llevó a una cabina cerrada construida con plásticos que no dejaban atravesar la luz UV que se encuentra en su interior y que a su vez posee un generador de corriente eléctrica donde se colocan los electrodos, dicha cabina recibe el nombre de hemoactivador. Una vez colocado el vaso con la muestra dentro del activador se sumergen los electrodos, se activa la luz ultravioleta y los electrodos durante 5 minutos.
- Se registraron los cambios físicos – químicos ocurridos en la muestra: volumen de espuma y color.
Los resultados se interpretaron de la siguiente manera:
Negativo (-): espuma color blanco en la superficie, volumen variable. Este resultado es ideal, indica equilibrio redox, los mecanismos antioxidantes endógenos contrarrestan la producción de radicales libres.
Valores 1/10 (+/-): espuma solo alrededor de los electrodos, se observan al retirar el vaso del hemoactivador, dos puntos de color verde, marrón o negro. Este resultado puede indicar un ligero desbalance (Ver figura 1).
Valores 1/25 (+); 1/50 (++); 1/75 (+++) y 1/100 (++++): la espuma con los colores indicados cubre el 25, 50, 75 y 100 % respectivamente. Indican desequilibrio redox con incremento de radicales libre en circulación (Ver figura 2).


Los 2 ml restantes de sangre entera que se extrajeron a cada animal se colocaron en tubos con citrato y se centrifugaron a 1500 rpm durante 10 minutos. El plasma obtenido de cada muestra se fraccionó en tres tubos para las mediciones de MDA, tioles totales no proteicos y ácido ascórbico de la siguiente manera:
- 300 µl de plasma con 3 µl butitil-hidrociltolueno (BHT) como conservante para la evaluación de MDA.
- 250 µl de plasma con 250 µl de ácido metafosfórico como conservante para la evaluación de tioles totales no proteicos.
- 500 µl sin conservante para la medición de ácido ascórbico.
Las muestras fueron conservadas inmediatamente en freezer a -20°C durante un período no mayor a 5 días para su procesamiento. Estas mediciones se llevaron a cabo en la Cátedra de
Química General e Inorgánica de la Facultad de Farmacia y Bioquímica de la Universidad de
Buenos Aires y la metodología utilizada para cada una fue la siguiente:
-Niveles de sustancias reactivas al ácido tiobarbiturico (TBARS-MDA) por determinación fluorométrica de acuerdo al método de Kunio Yagi,19767.
-Contenido de grupos tioles totales no proteicos por determinación espectrofotométrica basada en el método de Tietze, 196918.
-Ácido ascórbico por determinación espectrofotométrica basada en el método de Kyaw, 19788.
Resultados
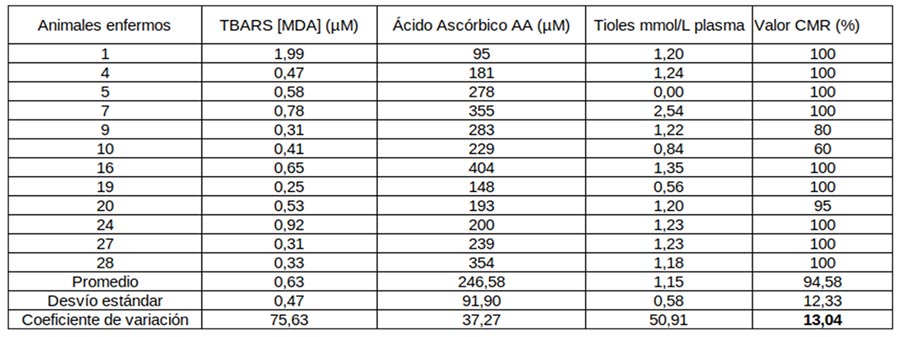
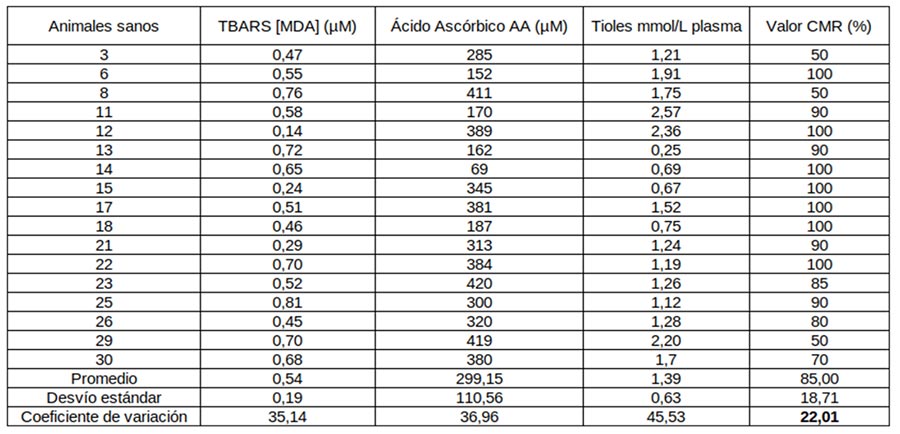
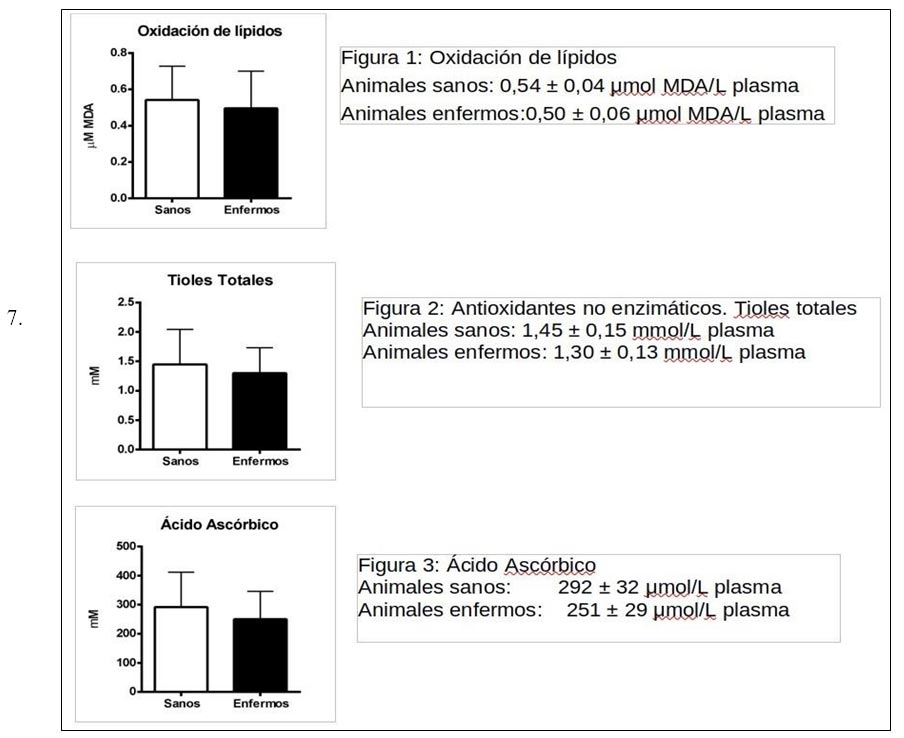
En los cuadros 1 y 2 podemos observar los resultados de las mediciones cuantitativas de MDA, tioles totales no proteicos y ácido ascórbico en plasma canino considerados a nivel clínico como “enfermos” y “sanos” respectivamente. En la última columna de cada cuadro podemos observar los resultados de los valores de CMR % para cada grupo. A su vez, se calculó promedio, desvío estándar y coeficiente de variación (CV) para los cuatro grupos de mediciones en ambos grupos de animales. Los valores observados para el CV en MDA, tioles totales no proteicos y ácido ascórbico de los dos grupos de animales fueron superiores al 20 %, siendo muy altos en lo que respecta a mediciones biológicas, es decir las tres pruebas cuantitativas demostraron tener una alta variabilidad. En lo que respecta a los valores de las mediciones de CMR % de tipo cualitativo presentaron una variabilidad del 13 % en el grupo de animales enfermos y del 22 % en el grupo de animales sanos. En las figuras 1, 2 y 3 se puede observar en los tres tipos de mediciones de tipo cuantitativo que no existen diferencias significativas entre los grupos de animales estudiados.
La interpretación del “estado oxidativo” de todos los valores estimados de CMR% que arrojaron ambos grupos de animales fue de desequilibrio redox.
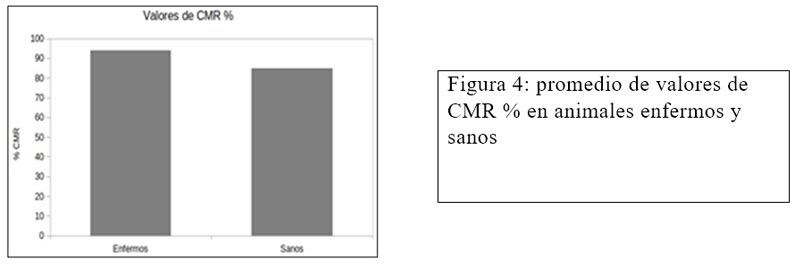
En la figura 4 se observa el promedio de valores de CMR % en animales enfermos y sanos, si
bien con estos valores los dos grupos se interpretan como desequilibrio redox se puede observar una leve disminución del estrés oxidativo en el grupo de animales sanos.
Cuadro 1: mediciones cuantitativas de la reacción del tiobarbitúrico (TBARS) con el malondialdehído (MDA), tioles totales no proteicos, ácido ascórbico y CMR en plasma canino de animales considerados clínicamente enfermos.
Cuadro 2: mediciones cuantitativas de la reacción del tiobarbitúrico (TBARS) con el malondialdehído (MDA), tioles totales no proteicos, ácido ascórbico y CMR en plasma canino de animales considerados clínicamente sanos.
Discusión
Para comenzar a discutir sobre la utilidad o no del CMR% debemos tratar de entender cual es la metodología de análisis para medir el estrés oxidativo con esta técnica. Como se mencionó anteriormente como parte de la técnica se agrega peróxido de hidrógeno, el mismo ocupa un rol fundamental en la regulación del estrés oxidativo a nivel fisiológico. Como explican Valko et al.,
200422 se sabe que los peroxisomas son las organelas celulares donde se produce gran cantidad de peróxido de hidrógeno en condiciones fisiológicas. Asimismo son sitios importantes de consumo de oxígeno en la célula y participan en varias funciones metabólicas que lo utilizan. El
consumo de oxígeno en el peroxisoma conduce a la producción de H2O2, que luego se utiliza para oxidar una variedad de moléculas. El orgánulo también contiene catalasa, que descompone el peróxido de hidrógeno y presumiblemente evita la acumulación de este compuesto tóxico.
Por lo tanto, el peroxisoma mantiene un delicado equilibrio con respecto a las concentraciones o
actividades relativas de estas enzimas para asegurar que no haya producción neta de EROs. Cómo el orgánulo mantiene este equilibrio no está claro. Cuando los peroxisomas están dañados y sus enzimas no regulan el consumo de H2O2, el H2O2 se libera en el citosol contribuyendo significativamente al estrés oxidativo. A su vez, el mecanismo fisiológico más eficiente para neutralizar el peróxido de hidrógeno es por la enzima glutatión peroxidasa (Gpx) que requiere glutatión como donante de electrones resultando en la formación de glutatión disulfuro, H2O y O223.
Asimismo, como parte de la técnica para realizar el CMR % se somete a la muestra de sangre a luz ultravioleta dentro del denominado “hemoactivador”, este concepto se basa en la afirmación ampliamente demostrada que las conexiones entre la radiación ionizante y la generación de ROS son íntimas y directas9. Existe evidencia de estudios in vitro de que la radiación UVA de macromoléculas puede causar la generación de peróxido de hidrógeno (H2O2) y anión superóxido19, 21. Los tubos de luz UV disponible en el mercado son de diferentes rangos de longitudes de onda, al utilizar rangos que estén dentro de la radiación UVA (320-380 nm) se asegura que se produzca el estrés oxidativo intracelular que se mencionó anteriormente en la muestra de sangre. Asimismo, se sabe que los efectos celulares inmediatos de las dosis fisiológicamente relevantes de UVA incluyen el agotamiento del contenido de glutatión celular (GSH) y la peroxidación de los lípidos de la membrana entre otros3,5,12,14,20,26,27,29,30.
Por otra parte, debemos tener en cuenta la actividad de los electrodos que se sumergen en la muestra de sangre. Partiendo de la premisa que la sangre posee en su composición abundantes moléculas de agua el efecto que se logra al introducir los electrodos puede ser el mismo que se produce en la electrólisis del agua. Una corriente eléctrica que pasa a través del agua da como resultado agua reducida electrolizada (electrolyzed reduced water-ERW) cerca del cátodo y agua oxidada electrolizada cerca del ánodo. ERW elimina eficazmente las especies reactivas de oxígeno (ROS) producidas como subproducto del metabolismo celular normal16.El daño del ADN inducido por ROS y la degradación del ARN son significativamente inhibidos por ERW in vitro10. ERW también previene la escisión oxidativa de proteínas celulares en linfocitos humanos10.
Por lo tanto, podemos decir que la técnica de CMR% se basa en la capacidad de respuesta inmediata que posee la muestra de sangre frente a la exposición in vitro de oxidantes como H2O2 o luz UV y los efectos antioxidantes de ERW. Entendiendo estos conceptos podemos inferir que el status oxidativo que posee el animal al cual se le toma la muestra de sangre es crucial para el resultado que generará el CMR%, si el animal tienen niveles de antioxidantes como glutatión y/o ácido ascórbico que puedan combatir el embate oxidativo al que somete la muestra no va a dar los mismos resultados que si están en baja concentración.
En el presente estudio y con la cantidad de animales testeados no se pudo demostrar que hubiera
diferencias significativas entre los grupos de animales sanos y enfermos con las mediciones de carácter cuantitativo (MDA, tioles totales no proteicos y ácido ascórbico). Asimismo, notamos una gran variabilidad en los resultados para ambos grupos en lo que respecta a estas mediciones por lo cual en principio se debería aumentar el número de muestras para disminuir esta variabilidad antes de sacar conclusiones erróneas.
Con estos resultados tampoco podemos asegurar que hubiera concordancia con los resultados observados en el CMR%, debido a que tampoco hubo diferencias para esta medición entre grupo de animales sanos y enfermos ya que la interpretación de todos ellos fue que estaban en desequilibrio redox.
Conclusiones
Debido a la importancia que posee el estrés oxidativo en la generación de enfermedades y que en la actualidad los métodos de análisis de tipo cuantitativo para evaluarlo resultan casi imposible de llevar a cabo en la práctica médica diaria consideramos que resultaría muy útil que el médico (humano y/o veterinario) tenga acceso a este tipo de metodología de análisis como es el CMR %. Por lo tanto, si bien la técnica de CMR% posee un buen fundamento teórico y resulta muy práctico para realizar por el profesional debemos ampliar los estudios para validar esta técnica de análisis.
En principio y como se mencionó anteriormente aumentando el número de muestras pero también adicionar mediciones de carácter cuantitativo para que los resultados sean más representativos.
Referencias bibliográficas
1) Bottari, N. B., Munhoz, T.D., Torbitz V.D., Tonin A.A., Anai L.A, Semolin L.M.S., Jark, P.C., Bollick,Y.S., Moresco,R.N., França, R.T., Lopes, S.T.A., Stefani, L.M., Tinucci-Costa, M., Da Silva, A.S.Oxidative stress in dogs with multicentric lymphoma: Effect of chemotherapy on oxidative and antioxidant biomarkers.Redox Report. VOL.20 N°6, 267-274.
2) Castillo C., Hernandez,J., Bravo, A., Lopez-Alonso, M., Pereira, V., Benedito, J.L(2005)Oxidative status during late pregnancy and early lactation in dairy cows. The Veterinary Journal 169, 286–292
3) Djavaheri-Mergny, M., J. L. Mergny, F. Bertrand, R. Santus, C. Maziere, L.Dubertret and J. C. Maziere (1996) Ultraviolet-A in duces activation of AP-I in cultered human keratinocytes. FEBS Lett. 384,92-96.
4) Dotan, Y., Lichtenberg,D., Pinchuk. I. 2004. Lipid peroxidation cannot be used as a universal criterion of oxidative stress. Progress in Lipid Research 43, 200–227
5) Klotz, L. 0.. K. Brivida and H. Sies (1997) Singlet oxygen mediates the activation of JNK by UVA radiation in human skin fibroblasts. FEBS k i t . 408, 289-291.
6) Kovacic, P., & Jacintho, J. D. (2001). Mechanisms of carcinogenesis:Focus on oxidative stress and electron transfer. Curr. Med. Chem.,8, 773–796.
7) Kunio Yagi. A simple fluorometric assay for lipoperoxide in blood plasma. Biochemical Medicine. Volume 15, Issue 2, April 1976, Pages 212-216. https://doi.org/10.1016/0006-2944(76)90049-1.
8) Kyaw, Aye. A simple colorimetric method for ascorbic acid determination in blood plasma.
Clinica Chimica Acta,Volume 86, Issue 2,1978, Pages 153-157,https://doi.org/10.1016/0009-8981(78)90128-6.
9) Lane, N. (2002) Oxygen: The Molecule That Made the World. Oxford University Press, New York, NY, USA.
10) Lee MY, Kim YK, Ryoo KK, Lee YB, Park EJ (2006) Electrolyzed-reduced water protects against oxidative damage to DNA, RNA, and protein. Appl Biochem Biotechnol 135:133-144.
11) Lykkesfeldt, Jens y Svendsen, Ove. (2007) Oxidants and antioxidants in disease: Oxidative stress in farm animals. The Veterinary Journal 173; 502–511
12) Morliere, P., A. Moysan, R. Santus, G. Huppe, J.-C. Maziere and L. Ertret (1991) UVA-induced lipid peroxidation in cultured human fibroblasts. Biochim. Biophys. Acta 1084, 261-268.
13) Pérez Gastell, Pedro Luis y Pérez de Alejo, José Luis. (2000). Métodos para medir el daño oxidativo. Rev Cubana Med Milit 29(3):192-8
14) Punnonen, K., C. T. Jansen. A. Puntala and M. Ahotoupa (1991) Effects of in vitro UVA irradiation and PUVA treatment on membrane fatty acids and activities of antioxidant enzymes in human keratinocytes. J. Invest. Dermatol. 96,255-259.
15) Ridnour, L. A., Isenberg, J. S., Espey, M. G., Thomas, D. D., Roberts,D. D., & Wink, D. A. (2005). Nitric oxide regulates angiogenesis through a functional switch involving thrombospondin-
1. Proc. Natl. Acad. Sci. U.S.A., 102, 13147–13152.
16) Shirahata S, Kabayama S, Nakano M, Miura T, Kusumoto K, Gotoh M, Hayashi H, Otsubo K, Morisawa S, Katakura Y (1997) Electrolyzed-reduced water scavenges active oxygen species and protects DNA from oxidative damage. Biochem Biophys Res Commun 234:269-274.
17) Sordillo, Lorraine M. y Aitken, Stacey L.(2009). Impact of oxidative stress on the health and immune function of dairy cattle. Veterinary Immunology and Immunopathology 128; 104–109
18) Tietze, Frank. Enzymic method for quantitative determination of nanogram amounts of total and oxidized glutathione: Applications to mammalian blood and other tissues. Analytical Biochemistry, Volume 27,Issue 3,1969,Pages 502-522. https://doi.org/10.1016/0003-2697(69)90064-5.
19) Tyrrell, R. M. (1991) UVA (320-380 nm) radiation as an oxidative stress. In Oxidative Stress: Oxidants and Antioxidants (Edited by H. Sies), pp. 57-83. Academic Press, London.
20) Tyrrell, R. M. (1996) Activation of mammalian gene expression by the UV component of sunlight-from models to reality. BioEssays 18, 139-148.
21) Tyrrell, R. M., S. M. Keyse and E. C. Moreas (1991) Cellular defence against UVA (320-380 nm) and UVB (290-320 nm) radiations. In Photobiology (Edited by E. Riklis), pp. 861-87 1. Plenum Press, New York.
22) Valko, M., Izakovic, M., Mazur, M., Rhodes, C. J., & Telser, J. (2004). Role of oxygen radicals in DNA damage and cancer incidence. Mol. Cell. Biochem., 266, 37–56.
23) Valko, M., Leibfritz D., Moncol, J., Cronin M.T.D., Mazur, M., Telser, J,. Free radicals and antioxidants in normal physiological functions and human disease. The International Journal of Biochemistry & Cell Biology 39 (2007) 44–84
24) Valko, M., Morris, H., Mazur, M., Rapta, P., & Bilton, R. F. (2001).Oxygen free radical generating mechanisms in the colon: Do these miquinones of Vitamin K play a role in the etiology of colon cancer? Biochim. Biophys. Acta, 1527, 161–166.
25) Valko, M., Rhodes, C. J., Moncol, J., Izakovic, M., & Mazur, M. (2006).Free radicals, metals and antioxidants in oxidative stress-induced cancer. Chem. Biol. Interact., 160, 1–40.
26) Vile, G. F., A. Tanew-llitschew and R. M. Tyrrell (1995) Activation of NF-KB in human skin fibroblasts by the oxidative stress generated by UVA radiation. Photochem. Photobiol. 62,463-468.
27) Vile. G. F. and R. M. Tyrrell (1995) UVA radiation-induced oxidative damage to lipids and proteins in vitro and in human skin fibroblasts is dependent on iron and singlet oxygen. Free Radical B i d . di Med. 18,721-730.
28) Winter, J.L., Barber, L.G.,Freeman, L., Griessmayr, P.C., Milbury, P.E. and Blumberg, J.B. (2009) Antioxidant Status and Biomarkers of Oxidative Stress in Dogs with Lymphoma. J Vet Intern Med; 23:311–316
29) Wlaschek, M., K. Brivida, G. P. Stricklin, H. Sies and K. Scharffetter-Kochanek ( 1995) Singlet oxygen may mediate the ultraviolet A-induced synthesis of interstitial collagenase. J.
Invest. Dermatol. 104, 194-198.
30) 27) Wlaschek, M., J. Wenk, P. Brenneisen, K. Brivida, A. Schwarz, H. Sies and K. Scharffetter- Kochanek (1997) Singlet oxygen is an early intermediate in cytokine-dependent ultraviolet-A induction of interstitial collagenase in human dermal fibroblasts in vitro. FEBS Lert. 413,239
Notas:
[1] Correo de contacto: (meneses.laura@gmail.com) Carrera de Bioingeniería del Instituto de Ingeniería. Universidad Nacional Arturo Jauretche/ Facultad de Ciencias Veterinarias. Universidad Nacional de La Plata
[2] Clínica Veterinaria “Julia Lavalle Medicina Biológica”. Ciudad Autónoma de Buenos Aires
[3] Clínica Veterinaria “Julia Lavalle Medicina Biológica”. Ciudad Autónoma de Buenos Aires.