Structural and functional studies of surface proteins (S-layer) from lactobacilli for the development of new vaccine adjuvants
Bolla, Patricia Araceli[1] (patobolla@hotmail.com; pbolla@unaj.edu.ar)
Malamud, Mariano[2] (malamudmariano@gmail.com; m.g.malamud@exeter.ac.uk)
Ruggera, José Fernando[3] (jfruggera@gmail.com; jfruggera@unaj.edu.ar)
Serradell, María de los Ángeles[4] (maserr@biol.unlp.edu.ar; mserradell@unaj.edu.ar)
Resumen
La capa S es una envoltura (glico)-proteica bidimensional auto-ensamblada presente en numerosas bacterias a la que se han atribuido diversas funciones. Las subunidades aisladas de proteína (SLP) se auto-ensamblan formando arreglos regulares a escala nanométrica, y en estudios in vitro realizados previamente, demostramos que la SLP de Lactobacillus kefiri CIDCA 8348 (SLP- 8348) potencia la respuesta de macrófagos murinos al LPS de manera Ca+2-dependiente, sugiriendo la participación de los glicanos y su reconocimiento por receptores de lectina tipo-C (CLR). Por ello, decidimos estudiar la inmunogenicidad de las SLP de L. kefiri y su capacidad potenciar la inmunidad adaptativa específica frente a otros antígenos (efecto adyuvante), a la vez que buscamos conocer aspectos de la estructura que pudieran influir en su auto-ensamblado en solución.
Durante el desarrollo del proyecto demostramos que las SLP provenientes de tres cepas de L. kefiri son capaces de activar células presentadoras de antígeno y potenciar la activación inducida por LPS a través del reconocimiento vía CLR, lo que redunda en una mayor capacidad para estimular LTCD4+ antígeno-específicos. Las SLP-8321 y SLP-8348 ejercen su efecto vía Mincle, mientras que la SLP-5818 lo hace a través de SignR3. Asimismo, estudios in vivo permitieron demostrar la importancia de la integridad de los glicanos en la inmunogenicidad y en la adyuvanticidad de la SLP- 8348. Mediante TEM demostramos que la SLP-8348 adopta una geometría hexagonal al auto- ensamblarse en solución.
Por lo tanto, las SLP de L. kefiri emergen como herramientas valiosas para el desarrollo nuevos adyuvantes vacunales provenientes de bacterias seguras.
Palabras claves: Lactobacillus kefiri; vacunas; autoensamblado; receptores de lectina tipo C
Abstract:
The S-layer is a two-dimensional self-assembled (glyco)-protein envelope present in numerous bacteria to which various functions have been attributed. Isolated protein subunits (SLP) self-assemble into regular nanometer-scale arrays, and in previously performed in vitro studies, we demonstrated that SLP from Lactobacillus kefiri CIDCA 8348 (SLP-8348) potentiates the murine macrophage response to LPS in a Ca+2-dependent manner, suggesting the involvement of glycans and their recognition by C-type lectin receptors (CLRs). Therefore, we decided to study the immunogenicity of L. kefiri SLPs and their ability to enhance specific adaptive immunity against other antigens (adjuvant effect), while seeking to understand aspects of the structure that could influence their self-assembly in solution.
During the development of the project, we were able to prove that SLPs from three strains of L. kefiri activate antigen-presenting cells and enhance LPS-induced activation through recognition via CLR, resulting in a greater capacity to stimulate antigen-specific LTCD4+. SLP-8321 and SLP- 8348 exert their effect via Mincle, while SLP-5818 does so through SignR3. In vivo studies have also demonstrated the importance of glycan integrity in the immunogenicity and adjuvant capacity of SLP- 8348. By TEM we demonstrated that SLP-8348 adopts a hexagonal geometry upon self-assembly in solution.
Therefore, SLPs from L. kefiri emerge as valuable tools for the development of novel vaccine adjuvants from safe bacteria.
Keywords: Lactobacillus kefiri; vaccines; self-assembly; C-type lectin receptors
Introducción
En las últimas décadas, la revolución de la nanotecnología ha logrado atraer la atención de muchos investigadores alrededor del mundo dedicados al diseño y desarrollo de sistemas de vehiculización de diferentes tipos de biomoléculas basados en componentes microbianos (Fardajian 2018). Entre estos últimos, la capa S, una envoltura (glico)-proteica macromolecular bidimensional auto-ensamblada que ha sido descripta en numerosas especies bacterianas, es considerada la membrana biológica más ancestral y se ha mantenido en los procariotas a lo largo de la evolución (Claus et al. 2005). Además, puede representar hasta el 15% de las proteínas celulares totales, por lo que podría considerarse uno de los biopolímeros más abundantes del planeta (Sleytr et al. 2014). Como componente de la superficie bacteriana, a la capa S se le han atribuido diversas funciones: mantenimiento de la forma celular, tamiz molecular, unión de iones y moléculas, mediación en la adhesión bacteriana e inmunomodulación (Gerbino et al. 2015). Las subunidades aisladas de proteína son capaces de auto-ensamblarse formando arreglos a escala nanométrica, tanto en suspensión, como en interfaces aire-líquido, sobre superficies sólidas, monocapas lipídicas, liposomas o partículas (Schuster & Sleytr 2020). Estos arreglos bidimensionales pueden adoptar, de acuerdo a la naturaleza de la capa S, una geometría oblicua (p2), cuadrada (p4) o hexagonal (p6) (Raff et al. 2016). Estas propiedades, junto con su regularidad estructural y su estabilidad mecánica, convierten a la capa S en una estructura orgánica única con altísimo potencial de aplicación en nanobiotecnología, como es la generación de vehículos GRAS (“generally regarded as safe”) para la administración de antígenos y moléculas de importancia biomédica, el desarrollo de reactivos en fase sólida como biocatalizadores, biosensores, etc (Farjadian et al. 2018, Wang et al. 2015). A su vez, dado que pueden ser modificadas química o genéticamente, representan una base estructural única para generar ensamblados supramoleculares complejos (Ilk et al. 2011).
En los últimos años, hemos orientado nuestros estudios a la evaluación, tanto in vitro como in vivo, de las propiedades probióticas de diferentes cepas de Lactobacillus kefiri aisladas de una leche fermentada artesanal conocida como kefir (Carasi 2014, Carasi et al. 2014, 2015, Zubiría et al. 2017), y a la caracterización estructural y funcional de sus proteínas de capa S (SLP), cuya presencia en esta especie fue descripta por primera vez hace 15 años en nuestro laboratorio (Garrote et al. 2004). Al momento de comenzar con el desarrollo experimental del presente proyecto, contábamos con información tanto estructural como funcional de las SLP de distintas cepas de L. kefiri disponibles en nuestro laboratorio. Desde el punto de vista estructural, se había demostrado que las SLP de L. kefiri están glicosiladas (Mobili et al. 2009) y presentan una gran heterogeneidad entre cepas a nivel de su secuencia de aminoácidos (Malamud et al. 2017). Asimismo, se había caracterizado la composición y estructura de los glicanos presentes en una de las cepas estudiadas (Cavallero et al. 2017). Desde el punto de vista funcional, estudios realizados por diferentes investigadores de nuestro grupo de trabajo habían demostrado que las SLP median procesos de inhibición de patógenos intestinales como Salmonella spp. y Clostridioides difficile, de coagregación con levaduras, y aumentan la adhesión de L. kefiri al mucus gastrointestinal (Malamud et al. 2019a). Más recientemente, habíamos podido demostrar, mediante ensayos in vitro, que la SLP de la cepa L. kefiri CIDCA 8348 (SLP-8348) es capaz de potenciar la respuesta de células presentadoras de antígenos (macrófagos murinos en cultivo) al estímulo por LPS de Escherichia coli, y que dicho efecto sinérgico se ve afectado por la presencia de EGTA (quelante fuerte de iones Ca+2) lo que sugiere la participación de los glicanos y su reconocimiento por receptores de lectina tipo C (CLR) en el efecto inmunoestimulatorio (Malamud et al. 2018). Los CLR son una familia de receptores de reconocimiento de patrones (RRP) que comparten al menos un dominio de reconocimiento de carbohidratos (CRD), el cual determina la especificidad por el carbohidrato (Sancho y Reis e Sousa 2012). Estos receptores, junto con otros RRP como los receptores tipo Toll (TLR), median la activación celular inducida por diferentes patrones moleculares asociados a microorganismos (MAMPs). Dicha estimulación, particularmente en las células presentadoras de antígenos, resulta esencial para el inicio de la respuesta inmune innata en el contexto de una infección o de una inmunización activa.
Considerando los resultados obtenidos, junto con la capacidad de autoensamblado, las SLP de L. kefiri emergen como herramientas de alto potencial para el desarrollo nuevos adyuvantes vacunales provenientes de bacterias ácido-lácticas seguras. En base a ello, el proyecto tuvo como objetivo general, el estudio de la capacidad de las glicoproteínas de capa S de L. kefiri para inducir una respuesta inmune (inmunogenicidad) y potenciar el desarrollo de inmunidad adaptativa específica frente a otros antígenos (efecto adyuvante), a la vez que se buscó conocer aspectos de la estructura de estas proteínas que pudieran influir en su auto-ensamblado en solución.
Metodología
1.1. Cepas bacterianas y condiciones de cultivo.
Las cepas de Lactobacillus kefiri utilizadas pertenecen a la colección del Centro de Investigación y Desarrollo en Criotecnología de Alimentos (CIDCA, UNLP-CONICET-CICPBA) (cepas CIDCA 8321, 8348, 83111) y la Colección Japonesa de Microorganismos (cepa JCM 5818). Los lactobacilos fueron crecidos en caldo MRS (de Mann-Rogosa-Sharpe), en aerobiosis a 37°C durante 48 hs (Malamud et al. 2017). La pureza de los cultivos fue verificada mediante observación microscópica de preparados fijados y teñidos por tinción de Gram. Las cepas fueron preservadas a -80°C en leche descremada estéril.
1.2. Extracción y obtención de proteínas de capa S (SLP) de L. kefiri.
La extracción de las SLP se llevó a cabo a partir de cultivos de L. kefiri en fase estacionaria. Se emplearon, alternativamente, dos métodos de extracción: uno que utiliza LiCl 5M como agente caotrópico (Malamud et al. 2017) y otro que emplea cloruro de guanidinio 5M (Bolla et al. 2020a), de acuerdo con protocolos ya optimizados en nuestro grupo de trabajo. En ambos casos, los extractos obtenidos fueron purificados mediante diálisis frente a buffer fosfato salino (PBS), y se determinó la concentración de proteína por el método de Bradford. La presencia de SLP en los extractos dializados y la calidad de la muestra fue verificada por SDS-PAGE (Malamud et al. 2017). Los extractos de SLP que se utilizaron en los ensayos con cultivos celulares fueron previamente esterilizados mediante filtración con membranas de acetato de celulosa de 0,22 m de diámetro de poro.
1.3. Ensayos funcionales en células presentadoras de antígenos (CPA).
Se emplearon dos modelos experimentales diferentes: la línea celular monocito-macrófago de origen murino Raw264.7 disponible en nuestro laboratorio, y células dendríticas derivadas de médula ósea (BMDCs). El cultivo y mantenimiento de la línea celular se realizó de acuerdo con los protocolos ya establecidos en nuestro grupo de trabajo (Malamud et al. 2018). Las BMDCs fueron obtenidas a partir de ratones C57BL/6 wild type y knock-out (Mincle-/-, CARD9-/-, SignR3-/-), siguiendo el protocolo de uso de animales de laboratorio 022-07-15, aprobado oportunamente por el CICUAL de la FCE-UNLP. Brevemente, se extrajo muestra de médula ósea de los fémures y tibias de ambas patas traseras en condiciones de esterilidad, se lisaron los glóbulos rojos y se cultivaron las células en medio IMDM suplementado al 10% con sobrenadante de las células P3-X63 (que contiene GM- CSF) a 37°C y atmósfera gaseada durante 8-10 días, tiempo al cual más del 80% de las células expresaban el marcador CD11c (verificado mediante citometría de flujo). Los ensayos con BMDCs fueron realizados por el Dr. Malamud en el marco de una beca para estadías cortas de la DAAD (Servicio Alemán de Intercambio Académico) en la Unidad de Inmunología y Centro de Investigación para Infecciones Emergentes y Zoonosis de la Universidad de Medicina Veterinaria de Hannover (Alemania), bajo la supervisión del Dr. Bernd Lepenies.
- Ensayos de internalización en BMDCs: Estos ensayos se realizaron siguiendo los protocolos descriptos por Rodriguez et al. 2015. Se ensayaron diferentes concentraciones de SLP- 8348, SLP-8321 y SLP-5818 (1-10 g/ml) previamente conjugadas con la sonda fluorescente Atto- 647-N (Sigma-Aldrich, EEUU). La internalización activa se determinó mediante citometría de flujo, calculando la diferencia de la intensidad de fluorescencia media (MFI) de las células incubadas a 37°C y 4°C.
- Ensayos de estimulación sobre Raw264.7 y BMDCs: En base a los resultados previamente obtenidos, se estudió el efecto de la co-incubación de diferentes SLPs (SLP-8348, SLP- 8321 y SLP-5818) a razón de 10 g/ml, con LPS de coli (0,1 g/ml) durante 24 hs (Malamud et al. 2018). Se analizó la secreción de las citoquinas pro-inflamatorias (IL-6, TNF-) en los sobrenadantes de cultivo empleando un ensayo de ELISA de captura comercial. En los macrófagos y las BMDCs se analizó la expresión superficial de señales co-estimulatorias (CD86, CD40) mediante citometría de flujo empleando anticuerpos específicos. Se incluyeron controles de células incubadas solo con medio de cultivo (DMEM) e incubadas solo con LPS (0,1 g/ml). Con el fin de evaluar la participación de los restos de azúcares, algunos ensayos se realizaron con la SLP-8348 sometida previamente a un tratamiento de oxidación moderada de los glicanos con periodato de sodio (SLPOx-8348) (Rodriguez et al. 2015).
1.4. Ensayos de interacción con receptores de lectina tipo C (CLR).
Teniendo en cuenta los resultados obtenidos, se llevaron a cabo estudios para determinar la naturaleza de los receptores implicados en el reconocimiento de las SLP-8321, SLP-8348, y SLP- 5818 por las células presentadoras de antígeno. Se llevó a cabo un ensayo tipo ELISA, sensibilizando con las SLPs (0,25 g; 16 hs a 4°C), bloqueando con solución de seroalbúmina bovina (1% p/v; 2 hs a temperatura ambiente), y empleando una biblioteca de proteínas de fusión CLR-hFc (0,25 g; 1 h a temperatura ambiente) y finalmente un anticuerpo anti-IgG humana conjugado a peroxidasa (1/3000, 1h a temperatura ambiente). Estos ensayos fueron realizados en el marco de una beca para estadías cortas (3 meses) de la DAAD (Servicio Alemán de Intercambio Académico) otorgada al Lic. Malamud en la Unidad de Inmunología y Centro de Investigación para Infecciones Emergentes y Zoonosis de la Universidad de Medicina Veterinaria de Hannover (Alemania), bajo la supervisión del Dr. Bernd Lepenies. Para evaluar la especificidad de la unión, se incluyeron los respectivos controles en presencia de EGTA 5mM.
1.5. Ensayos de co-incubación de BMDCs con linfocitos T CD4+.
Se aislaron esplenocitos de ratones transgénicos OT-II empleando Iscove´s DMEM, y luego de lisar los eritrocitos, las células se resuspendieron en buffer MACS (seroalbúmina bovina 0,5 %, EDTA 2 mM en PBS). Se obtuvieron las células T mediante separación magnética empleando un kit comercial Pan T II de acuerdo a las especificaciones del fabricante. Las células T se marcaron con CFSE y se colocaron en placas de cultivo de 96 pocillos (7×104 cél/fosa). Luego de 30 minutos, BMDCs tratadas previamente con ovalbúmina (OVA) o con OVA/SLP fueron añadidas e incubadas durante 72 hs. Se recolectaron los sobrenadantes de cultivo para cuantificar la secreción de IFN- mediante ELISA de captura comercial. La proliferación de los LT CD4+ se analizó mediante citometría de flujo. El índice de proliferación de los LT CD4+ dentro de cada grupo experimental fue calculado como la relación entre el porcentaje de células CD4+CFSElow y el porcentaje de células CD4+CFSElow incubadas con BMDCs previamente tratadas con OVA. Estos ensayos fueron realizados en el marco de una beca para estadías cortas (3 meses) de la DAAD (Servicio Alemán de Intercambio Académico) otorgada al Lic. Malamud en la Unidad de Inmunología y Centro de Investigación para Infecciones Emergentes y Zoonosis de la Universidad de Medicina Veterinaria de Hannover (Alemania), bajo la supervisión del Dr. Bernd Lepenies.
1.6. Estudio de la inmunogenicidad de las SLP de L. kefiri.
En base a los resultados obtenidos en los ensayos in vitro, se seleccionó la SLP de la cepa CIDCA 8348 (SLP-8348) para la realización de los ensayos in vivo. Se inmunizaron ratones BALB/c por vía subcutánea con 10 µg de SLP-8348 o SLP-8348 oxidada con periodato (oxidación química de glicanos) (SLPOx-8348). Luego de 10 días, se extrajeron células de los ganglios inguinales y se analizó la activación antígeno-específica de LT mediante citometría de flujo (marcación con CFSE) y secreción de IFN- en los sobrenadantes de cultivo mediante ELISA de captura comercial. Estos ensayos fueron realizados por el Dr. Malamud y la Dra. Carasi en el Laboratorio de Inmunobiología y Desarrollo de Vacunas de la Facultad de Medicina de la Universidad de la República (Montevideo, Uruguay), bajo la supervisión de la Dra. Teresa Freire.
1.7. Estudio de la capacidad adyuvante de las SLP de L. kefiri.
Tomando como base protocolos previamente optimizados en nuestro laboratorio y aprobados por el CICUAL de la Facultad de Ciencias Exactas de la UNLP (Protocolo 006-30-18), se inmunizaron ratones BALB/c de 5-6 semanas de edad, por vía subcutánea (en la región adyacente a la base de la cola) con ovalbúmina (OVA) a razón de 5-10 g/ratón, acompañada de SLP-8348 (5- 10 g/ratón) como adyuvante. Se incluyó un grupo de animales que recibió OVA en buffer fosfato salino (PBS), otro que solo recibió PBS y un grupo que recibió OVA acompañada de adyuvante de Freund incompleto (IFA) como control. Se trabajó con lotes de 5 animales cada uno y se realizó una única inoculación. Con el fin de evaluar el papel que cumplen los glicanos en la capacidad adyuvante, se incluyó un grupo de animales inmunizados con OVA, acompañada de SLPOx-8348. Para evaluar la respuesta celular anti-OVA, las células de ganglios inguinales de los ratones previamente inmunizados se extrajeron mediante disgregación mecánica de los órganos, se lavaron con PBS suplementado con suero fetal bovino (SFB) al 10% y se recuperaron por centrifugación. Se realizó un recuento en cámara de Neubauer y se marcaron las células con CFSE. Posteriormente, se realizaron los ensayos de activación antígeno-específica, incubando durante 72 hs con OVA (10 μg/ml). Se analizó la proliferación de linfocitos T CD4+ mediante citometría de flujo y la producción de IFN- en el sobrenadante de cultivo mediante ELISA de captura comercial. Se incluyeron controles sin OVA (control negativo) y con Concanavalina A (control positivo).
1.8. Estudios estructurales de las SLP de L. kefiri mediante microscopía electrónica de transmisión (TEM).
Para llevar a cabo estos estudios, se prepararon extractos de SLP a partir de cultivos de las cepas CIDCA 8348 y CIDCA 83111, empleando cloruro de guanidinio 5M como agente caotrópico. Las soluciones proteicas previamente dializadas frente a buffer Tris-HCl, fueron depositadas sobre grillas de cobre-carbono. Posteriormente se agregó ácido fosfotúngstico al 1% como contraste durante 40 segundos, se secaron en cámara de secado y se realizaron observaciones en un microscopio TEM FEI Talos 200.
1.9. Análisis estadístico.
El análisis estadístico de los resultados experimentales fue realizado con el programa GraphPad. Los valores de al menos tres experimentos independientes fueron analizados empleando un test de ANOVA, post-test de Tukey. Las diferencias se consideraron estadísticamente significativas para P<0,05.
2. Resultados
2.1. Las SLP de L. kefiri potencian la acción estimulatoria del LPS sobre los macrófagos murinos y sus glicanos están implicados en dicho efecto.
En base a los resultados previamente obtenidos con la SLP-8348 (Malamud et al. 2018),
decidimos estudiar la capacidad de las glicoproteínas SLP-8321 y SLP-5818 de activar macrófagos murinos usando la línea celular Raw264.7. Si bien ninguna de las SLP fue capaz de inducir la activación de las células Raw264.7 por sí solas, se observó un aumento significativo tanto en la secreción de IL-6 como en la expresión superficial de CD40 y CD86 cuando los macrófagos fueron simultáneamente expuestos al LPS de E. coli y las SLP, comparado con las células tratadas solo con LPS (Figura 1A y 1B). No se observaron diferencias en la capacidad estimulatoria de ambas glicoproteínas, a pesar de presentar diferencias en sus patrones de glicosilación (Malamud et al. 2020).
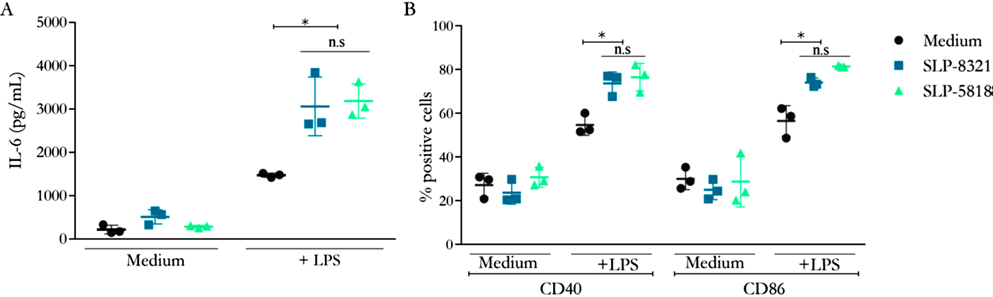
Figura 1. A) Concentración de IL-6 (pg/ml) por ELISA de captura en sobrenadante de cultivo de células Raw264.7 luego de 24h de estimulación. B) Porcentaje de células Raw264.7 CD40+ y CD86+ luego de 24 hs de estimulación. *P<0,05; n.s.: no significativo. (Extraída de Malamud et al. 2020)
Por otro lado, y con el fin de evaluar la participación de los glicanos en el efecto inmunoestimulatorio de las SLP de L. kefiri, la SLP-8348 fue sometida a un tratamiento de oxidación de los restos glicosídicos terminales (SLPOx-8348). Como puede observarse en la Figura 2A y 2B, la capacidad de la glicoproteína de potenciar la acción del LPS sobre las células Raw264.7 se reduce significativamente al perderse la integridad de los restos terminales de los glicanos.
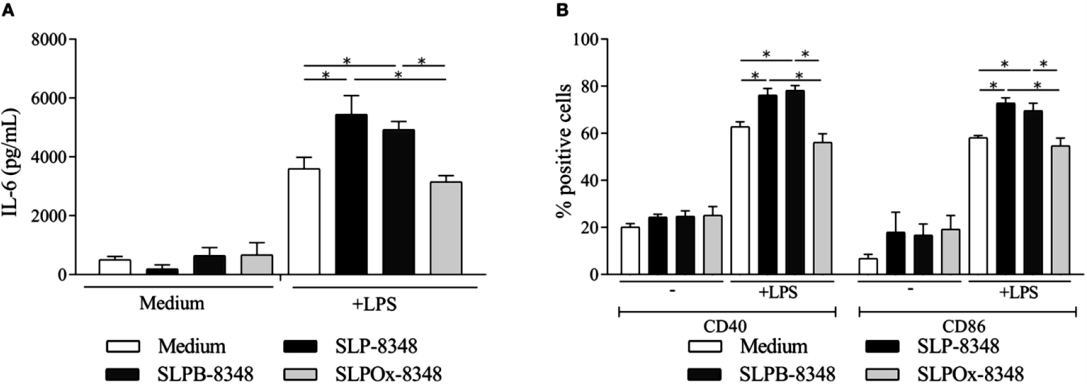
Figura 2. A) Concentración de IL-6 (pg/ml) por ELISA de captura en sobrenadante de cultivo de células Raw264.7 luego de 24h de estimulación. B) Porcentaje de células Raw264.7 CD40+ y CD86+ luego de 24 hs de estimulación. *P<0,05. (Extraída de Malamud et al. 2019b)
2.2. Las SLP de L. kefiri son reconocidas por diferentes CLR.
Considerando que los resultados obtenidos hasta el momento sugerían muy fuertemente la participación de receptores de lectinas tipo C (CLR) en el reconocimiento de las glicoproteínas SLP de L. kefiri, se llevaron a cabo ensayos de interacción tipo ELISA, empleando las SLP-8348, SLP- 8321 y SLP-5818, y una biblioteca de proteínas de fusión CLR-hFc (disponible en el laboratorio del Dr. Lepenies). Todas las SLP estudiadas mostraron capacidad de interacción, en mayor o menor medida, con todos los CLRs ensayados, con excepción del receptor MGL-1 (Figuras 3 y 4). Tal como se esperaba, la presencia de EGTA redujo aproximadamente en un 70% la capacidad de interacción SLP-CLR, lo cual confirma la participación del ión Ca+2 y la especificidad de unión SLP- CLR.
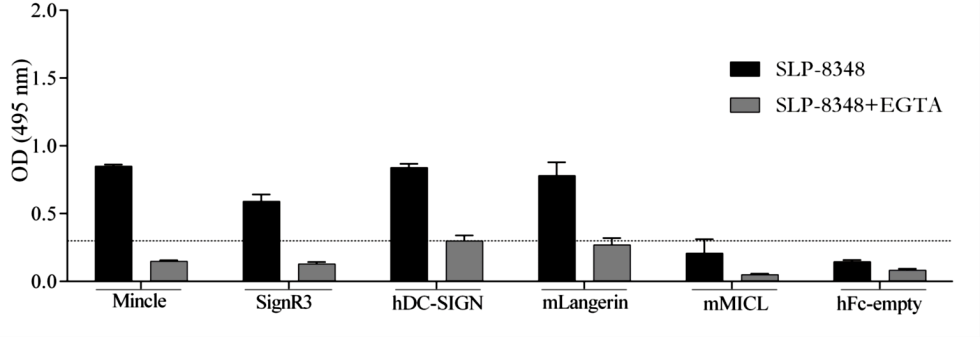
Figura 3. Interacción de las proteínas de fusión CLR-hFc con la SLP-8348. Ensayos de inhibición en presencia de EGTA. (Extraída de Malamud et al. 2019b).
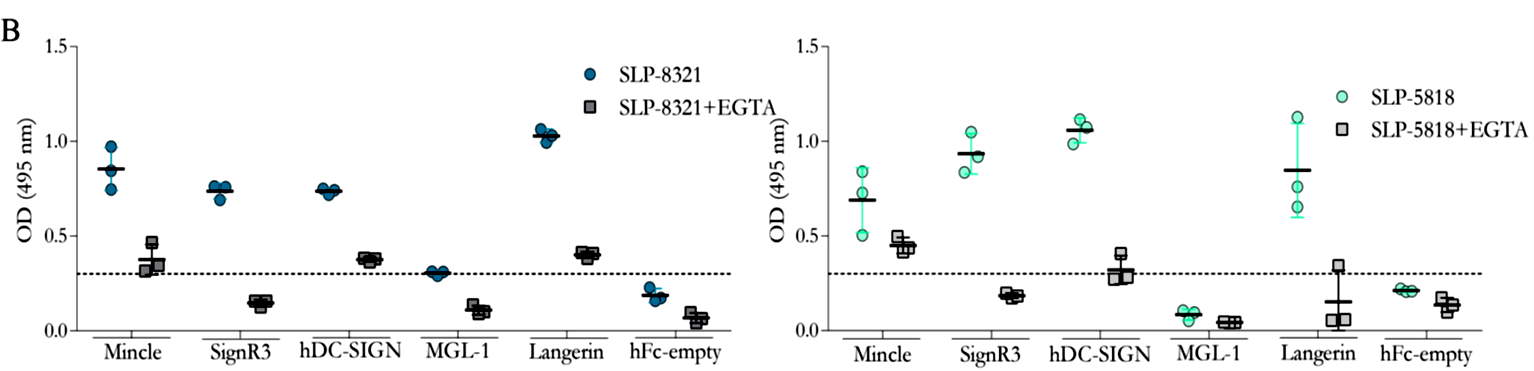
Figura 4. Interacción de las proteínas de fusión CLR-hFc con SLP-8321 y SLP-5818. Ensayos de inhibición en presencia de EGTA. (Extraída de Malamud et al. 2020).
- La internalización de las SLP de kefiri por las BMDCs está mediada por distintos CLRs. Tomando en cuenta los resultados de los ensayos de interacción con CLRs, y en base a los protocolos previamente optimizados con los macrófagos murinos (Malamud et al. 2018), decidimos estudiar la capacidad de las células dendríticas derivadas de médula ósea (BMDCs) para internalizar las diferentes SLP de L. kefiri, así como el rol de ciertos CLR en dicho proceso. Por eso, se trabajó con BMDCs diferenciadas a partir de precursores aislados de ratones C57BL/6 wiltd type (WT) y C57BL/6 knock-out (KO) para los receptores Mincle (Mincle-/-) y SignR3 (SignR3).
Tal como puede apreciarse en las Figuras 5 y 6, la internalización de SLP-8348 y SLP-8321 se ve significativamente disminuida en ausencia del receptor Mincle, lo cual indica su participación en el reconocimiento de ambas glicoproteínas. Por el contrario, la internalización de la SLP-5818 solo se vio afectada en ausencia del receptor SignR3.
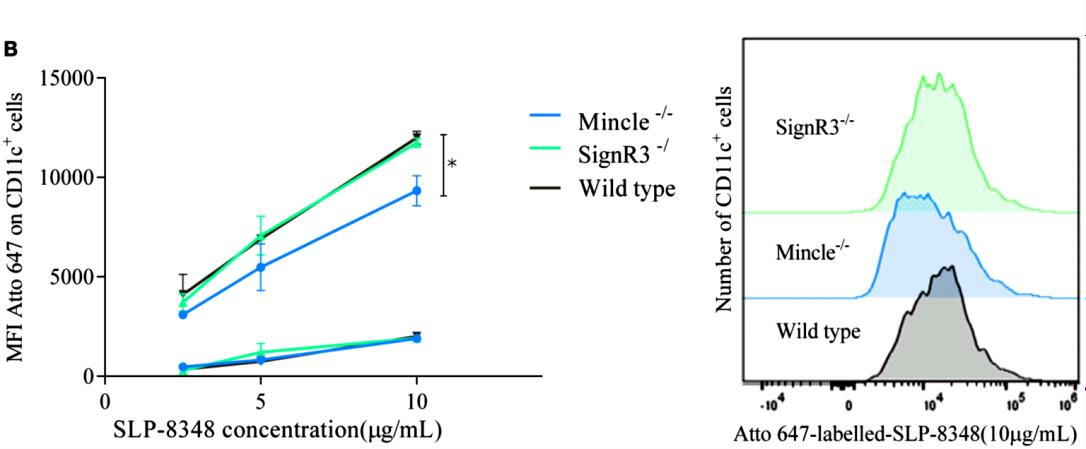
Figura 5. Unión (4°C, cuadrados) e internalización (37°C, círculos) de la SLP-8348 marcada con Atto- 647N a diferentes concentraciones en células CD11c+ de ratones C57BL/6 (WT y CLR-deficientes).
*P<0,05. (Extraída de Malamud et al. 2019b).
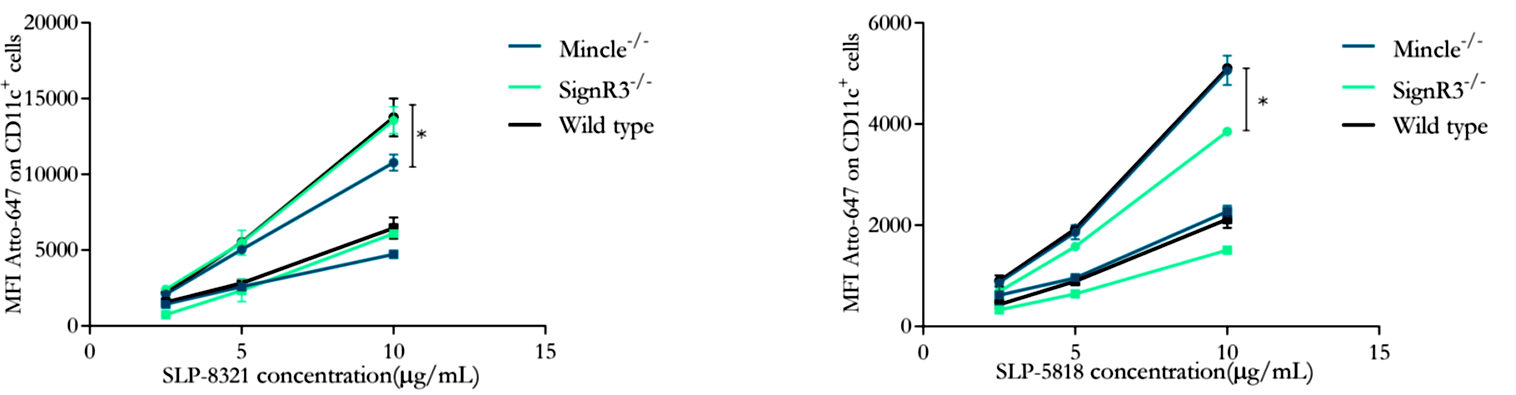
Figura 6. Unión (4°C, cuadrados) e internalización (37°C, círculos) de la SLP-8321 y SLP-5818 marcadas con Atto-647N a diferentes concentraciones en células CD11c+ de ratones C57BL/6 (WT y CLR-deficientes). *P<0,05. (Extraída de Malamud et al. 2020).
2.4. El reconocimiento de las SLP de L. kefiri por los CLRs induce la activación de las BMDCs e impacta en su capacidad estimuladora sobre linfocitos T CD4+.
Una vez establecido que las BMDCs eran capaces de internalizar las SLP de las cepas de L. kefiri estudiadas, analizamos el efecto de dicho proceso sobre la activación celular. Todas las SLP ensayadas fueron capaces de activar las BMDCs, generando un aumento significativo en los niveles secretados de IL-6 y TNF-, así como en la expresión de CD40 y CD80 (Figuras 7 y 8). El mismo efecto se observó al utilizar la combinación de las SLP con el LPS, lo que generó niveles aún mayores tanto de las citoquinas secretadas como de la expresión superficial de las moléculas co- estimulatorias respecto a las BMDCs estimuladas solo con LPS (Figuras 7 y 8).
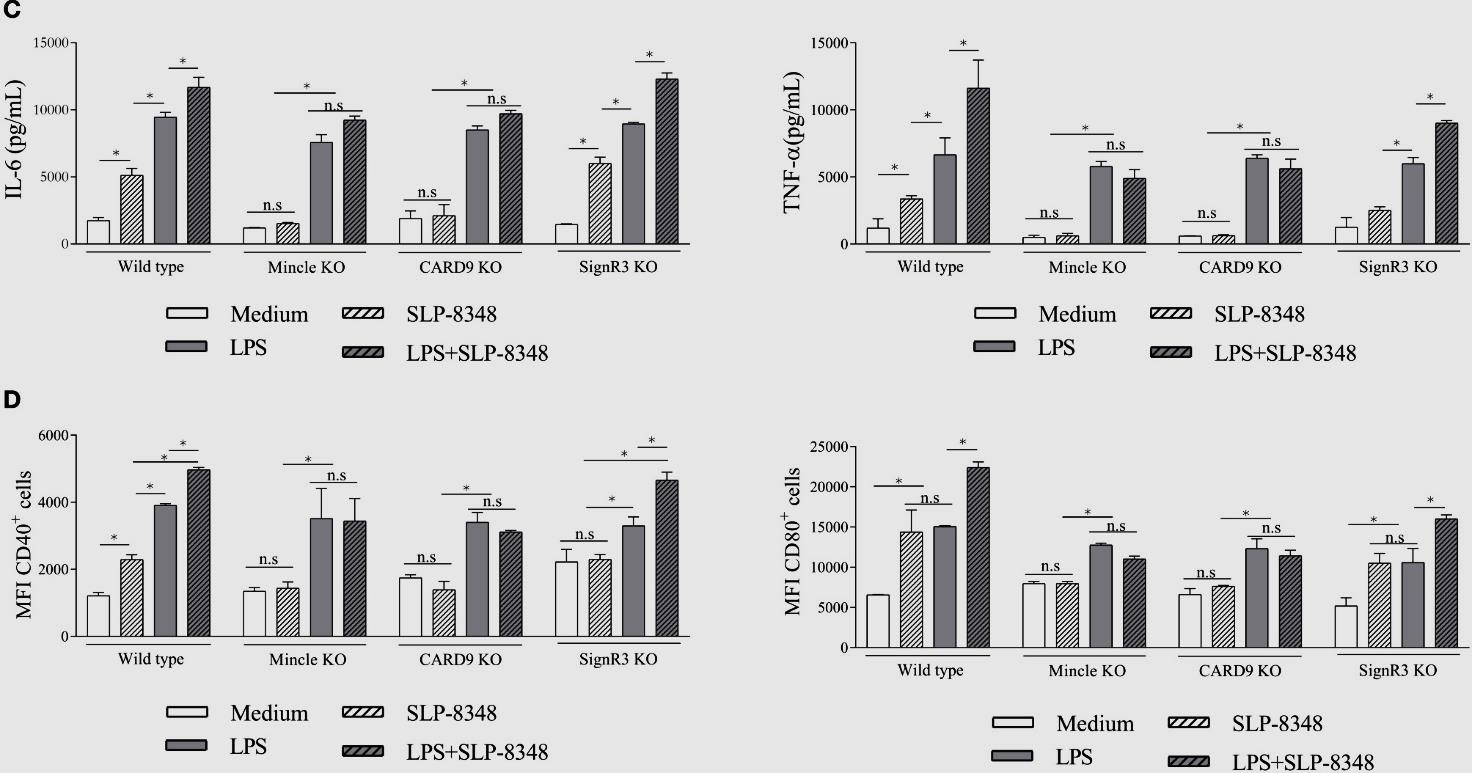
Figura 7. Ensayos de estimulación de BMDCs de ratones C57BL/6 wild type y deficientes (Mincle KO, SignR3 KO, CARD9 KO) con SLP-8348, LPS o combinación de ambos durante 24 hs. A) Concentración de IL-6 (pg/ml) y TNF- (pg/ml) por ELISA de captura en sobrenadante de cultivo. B) Expresión superficial de CD40 y CD86 mediante citometría de flujo. P<0,05; n.s: no significativo. (Extraída de Malamud et al. 2019b). KO: Knock-out.
Teniendo en cuenta los resultados obtenidos en los ensayos de internalización, se trabajó nuevamente con BMDCs diferenciadas a partir de precursores aislados de ratones C57BL/6 WT, Mincle-/- y SignR3-/-, y KO para la proteína adaptadora CARD9 (CARD9-/-), la cual es esencial en las vías de señalización intracelular mediadas por dichos CLR. En el caso de las SLP-8348 (Figura 7) y la SLP-8321 (Figura 8), la ausencia de señalización vía Mincle o la ausencia de CARD9 resultó en una producción significativamente menor de IL-6 y TNF-, y una menor expresión de CD40 y CD80 (P<0,05) en comparación con las BMDCs WT o SignR3-/-. El mismo resultado se observó al incubar las células con la combinación de SLP y LPS, lo que demuestra que Mincle y su adaptador de señalización CARD9 contribuyen a la estimulación generada por estas SLP y al efecto sinérgico con el LPS.
Por otro lado, para la SLP-5818 (Figura 8), la ausencia de SignR3 o su molécula adaptadora CARD9 generó una menor secreción de IL-6 y TNF- (P<0,05) y una disminución sginificativa de la expresión de CD40 y CD80 en comparación con las BMDCs WT o Mincle-/-. De la misma manera, la potenciación de la respuesta celular al LPS se vio inhibida en las BMDCs deficientes en SignR3 y CARD9, indicando que la señalización a través de SignR3 es la responsable del efecto inmunoestimulador de la SLP-5818.
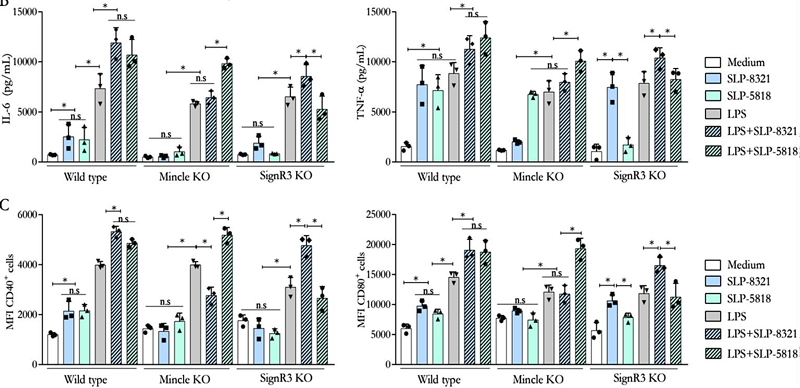
Figura 8. Ensayos de estimulación de BMDCs de ratones C57BL/6 wild type y deficientes (Mincle KO, SignR3 KO) con las SLP, LPS o combinación de ambos durante 24 hs. A) Concentración de IL-6 (pg/ml) y TNF- (pg/ml) por ELISA de captura en sobrenadante de cultivo. B) Expresión superficial de CD40 y CD86 mediante citometría de flujo. P<0,05; n.s: no significativo. (Extraída de Malamud et al. 2020).
Considerando estos resultados, analizamos si la activación de las BMDCs por las diferentes SLP modificaba su capacidad de estimular a los linfocitos T CD4+. Para ello se aislaron los LT CD4 a partir de ratones que expresan el receptor T (TCR) transgénico OT-II que reconoce el péptido de OVA 323-339 presentado en el contexto de una molécula de MHC-II haplotipo b. Las BMDCs derivadas de ratones C57BL/6 WT o deficientes para los distintos CLR o para CARD9, fueron previamente incubadas con OVA, en presencia o no de SLP-8348, SLP-8321 o SLP-5818, y luego cultivadas con los LT CD4 purificados de los ratones OT-II. Se observó tanto un aumento significativo en la proliferación de los LT CD4+ como en la secreción de IFN- cuando las BMDCS WT fueron estimuladas simultáneamente con OVA y las SLP (Figuras 9 y 10).
En concordancia con los resultados obtenidos en los ensayos de estimulación de las BMDCs, para la SLP-8348 y la SLP-8321, la ausencia de Mincle o CARD9 generó una menor activación de los LT CD4+ (P<0,05) (Figuras 9 y 10). En el caso de la SLP-5818 dicha situación se observó con las BMDCS derivadas de los ratones deficientes en SignR3 (Figura 10).
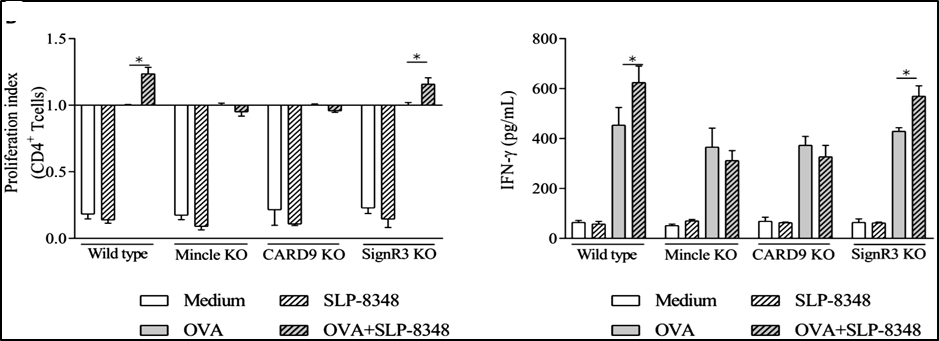
Figura 9. Activación de linfocitos T CD4+ de ratones OT-II (índice de proliferación y secreción de IFN- luego de 5 días de cultivo) incubados con BMDCs provenientes de ratones C57BL/6 (wild type y deficientes) previamente estimuladas durante 16 hs con OVA en presencia o no de SLP-8348. KO: knock-out. P<0.05. (Extraída de Malamud et al. 2019b).
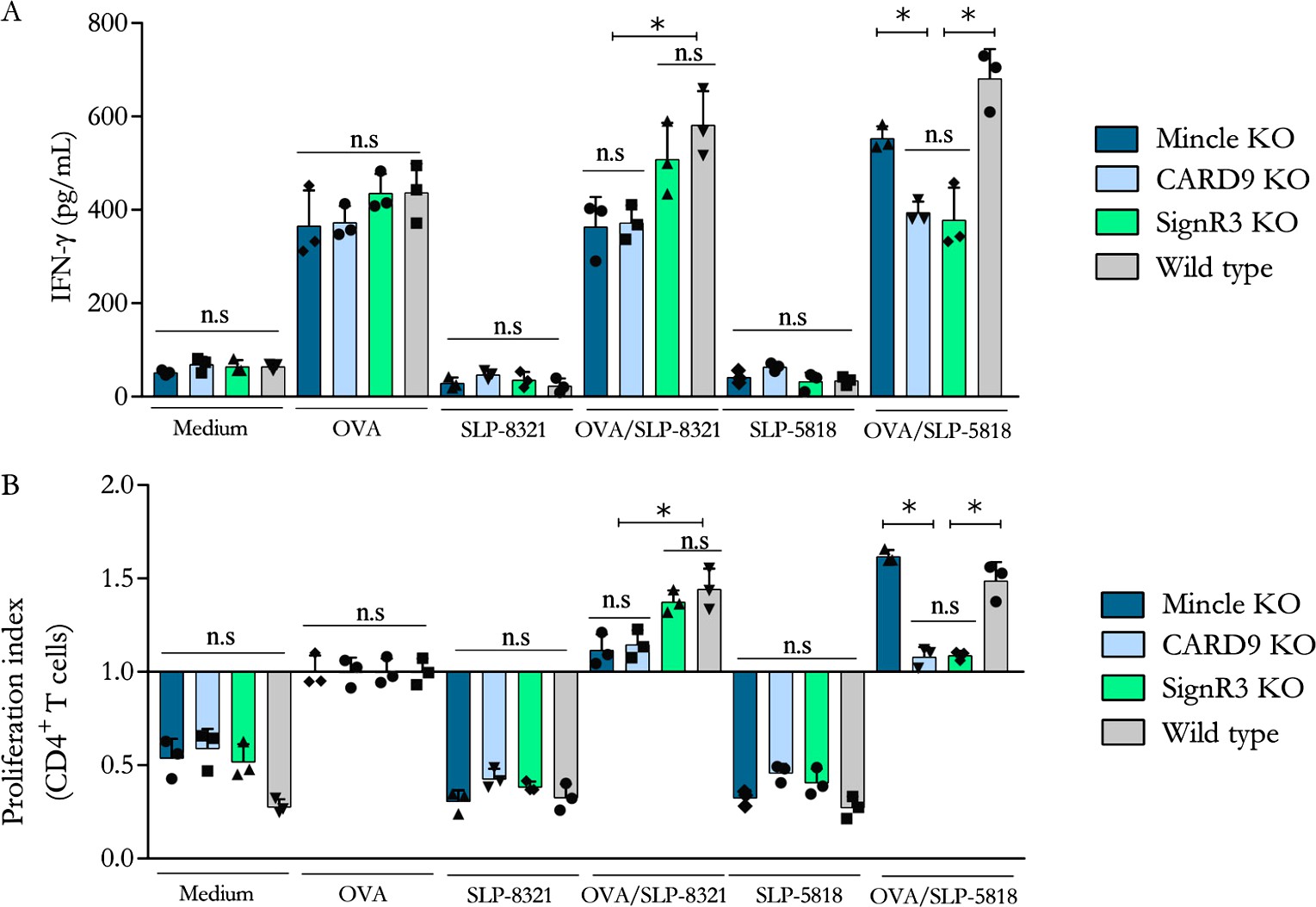
Figura 10. Activación de linfocitos T CD4+ de ratones OT-II incubados con BMDCs provenientes de ratones C57BL/6 (wild type y deficientes) previamente estimuladas durante 16 hs con OVA en presencia o no de SLP- 8321 o SLP-5818. Indice de proliferación (A) y secreción de IFN- (B) luego de 5 días de cultivo. KO: knock-out. P<0.05. (Extraída de Malamud et al. 2020).
2.5. La inmunogenicidad de la SLP de L. kefiri CIDCA 8348 (SLP-8348) disminuye al perderse la integridad de sus glicanos.
Considerando los resultados obtenidos en los ensayos in vitro, seleccionamos la SLP-8348 para la realización de los ensayos in vivo. La SLP-8348 fue inoculada por vía subcutánea (10 g/ratón) combinada con IFA a ratones BALB/c y se evaluó la proliferación de LT antígeno- específicos mediante la estimulación ex vivo con SLP-8348. Tanto el índice de proliferación de células T CD4+ como la secreción de IFN- fueron significativamente mayores en el grupo de ratones tratados con SLP-8348+IFA respecto a los ratones que no recibieron la SLP (PBS+IFA) (Figura 11A). Sorprendentemente, cuando las inmunizaciones se realizaron en ausencia de IFA, el grupo de ratones que recibió solo la SLP-8348 mostró respuestas similares a los tratados con SLP-8348+IFA, lo que indica que esta glicoproteína es altamente inmunogénica y tiene la capacidad inducir la proliferación y activación de LT CD4+ (Figura 11A).
Por otro lado, al inmunizar los ratones con la SLPOx-8348, la activación de los LT CD4+, evaluada mediante proliferación antígeno-específica y producción de IFN-, fue significativamente menor que la alcanzada con la inoculación de la SLP-8348 o de la SLPB-8348 (control de oxidación) (Figura 11B). Este resultado demuestra que la integridad de los glicanos es muy importante para la inmunogenicidad de la SLP8348.
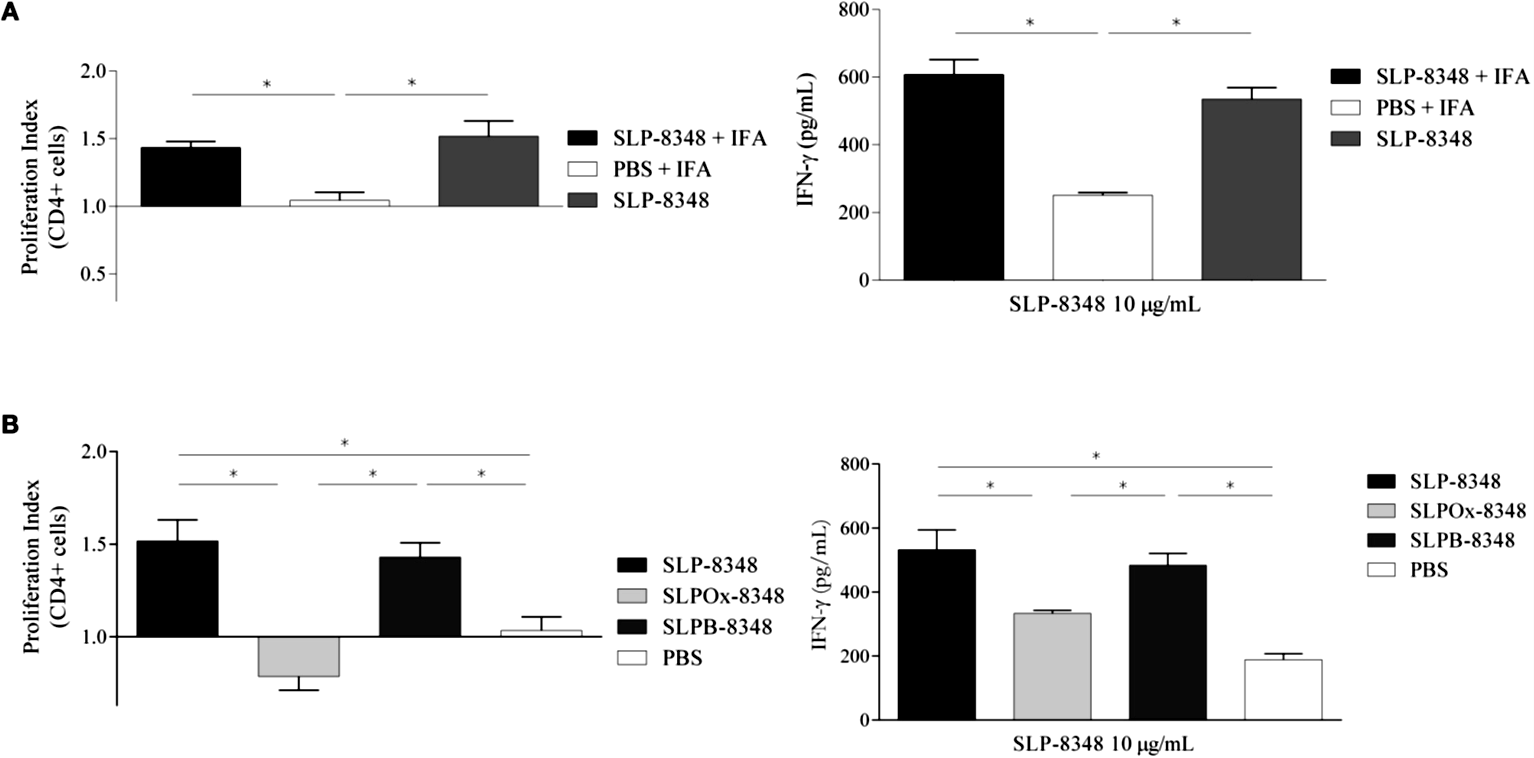
Figura 11. Estudio de la inmunogenicidad de la SLP8348. A) Índice de proliferación y secreción de IFN- en células de ganglios linfáticos inguinales de ratones BALB/c previamente inoculados en forma subcutánea con una dosis (10 μg/ratón) de SLP-8348 o PBS en combinación o no con adyuvante de Freund incompleto (IFA). B) Índice de proliferación y secreción de IFN- en células de ganglios linfáticos inguinales de ratones BALB/c previamente inoculados en forma subcutánea con una dosis (10 μg/ratón) de SLP-8348, SLPOx-8348 (oxidada) o SLPB-8348 (control de oxidación). Las determinaciones se realizaron luego de la estimulación in vitro con SLP-8348 (10 μg/ml) por 5 días. P<0,05. (Extraída de Malamud et al. 2019b).
2.6. La capacidad adyuvante de la SLP-8348 depende de la integridad de sus glicanos.
Para evaluar la capacidad adyuvante de la SLP-8348, ratones BALB/c fueron inmunizados por vía subcutánea con OVA u OVA+SLP-8348, y luego de transcurridos 10 días, se aislaron células de los ganglios linfáticos inguinales y se estimularon in vitro con OVA. Se observó que tanto el índice de proliferación de LT CD4+ específicos de OVA como la secreción de IFN- fueron significativamente más elevados en los animales inmunizados con OVA+SLP-8348 que en aquellos que recibieron solo OVA (Figura 12). A su vez, esta capacidad de potenciar la respuesta celular específica anti-OVA se vio significativamente reducida al emplear la SLPOx-8348 como adyuvante, lo cual indica que la integridad de los glicanos terminales es necesaria para la adyuvanticidad de la SLP-8348 (Figura 12).
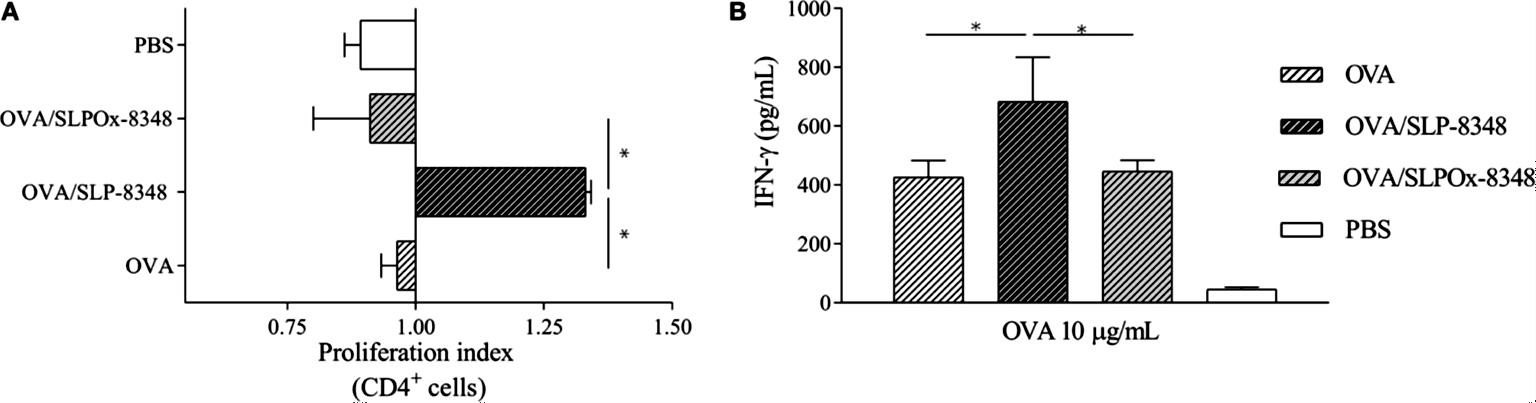
Figura 12. Estudio de la capacidad adyuvante de la SLP-8348 empleando OVA como antígeno. Ratones BALB/c fueron inoculados en forma subcutánea con una dosis de OVA en combinación o no con SLP-8348 o SLPOx-8348. Se determinaron los índices de proliferación de LT CD4+ (A) y los niveles de secreción de IFN- (B). PBS: control no inmunizado. (Extraída de Malamud et al. 2019b).
2.7. La SLP-8348 adopta una geometría de tipo hexagonal al formar agregados en solución.
Las imágenes de microscopía electrónica de transmisión de la SLP-8348 en solución depositada sobre la grilla de cobre-carbono, muestran que esta glicoproteína forma arreglos hexagonales (p6) con subunidades de un tamaño de aproximadamente 3 nm y con poros de 1,5 nm de diámetro (Figura 13).
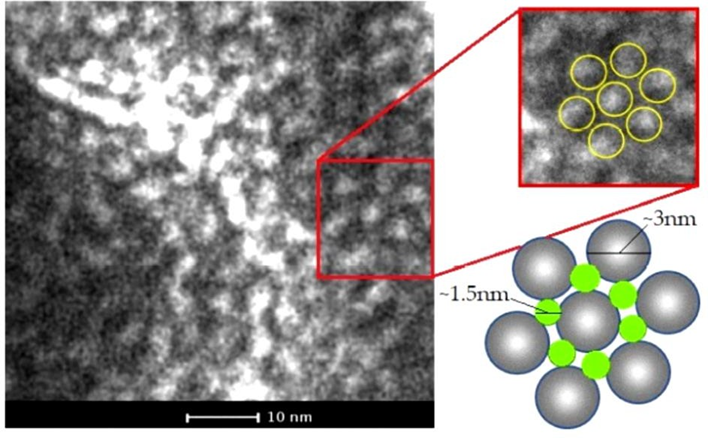
Figura 13. Micrografía TEM de la SLP-8348. Zoom y representación del arreglo p6 (derecha). (Extraída de Bolla et al. 2020b).
Discusión
En estudios previos al inicio del presente proyecto, habíamos demostrado que la glicoproteína SLP-8348 era capaz de potenciar la respuesta de macrófagos murinos (línea celular Raw264.7) al LPS (ligando del receptor TLR-4) y que dicho efecto sinérgico se perdía en presencia de EGTA, un quelante fuerte del ión Ca+2, lo cual sugería la participación de CLR en el reconocimiento de esta proteína de capa S (Malamud et al. 2018). Resultados similares fueron obtenidos, en el marco del proyecto, con las SLP-8321 y SLP-5818, a pesar de que, en base a estudios glicoproteómicos realizados en colaboración con otros investigadores, las mismas presentan diferencias en sus patrones de glicosilación (Malamud et al. 2020). Asimismo, la oxidación de los azúcares terminales de la SLP-8348 redujo significativamente el efecto sinérgico con el LPS sobre dichas células (Malamud et al. 2019b). Si bien otros autores han demostrado la capacidad inmunoestimuladora de las proteínas de capa S de L. helveticus sobre macrófagos murinos y humanos, dicho efecto fue atribuido a la interacción vía TLR-2 (Taverniti et al. 2013). Teniendo en cuenta estos resultados, y considerando que el reconocimiento de SLP por diferentes CLR ya ha sido descripto para L. acidophilus NCFM (Konstantinov et al. 2008, Lightfoot et al. 2015) y el patógeno oral Tannerella forsythia (Chinthamani et al. 2017), decidimos estudiar la interacción de las SLP de L. kefiri con diferentes CLR. En este sentido, la biblioteca de hCLR-Fc con la cual se realizaron los ensayos tipo ELISA constituyó una herramienta muy útil, y nos permitió demostrar la interacción SLP-CLR para todas las cepas estudiadas.
Al estudiar el proceso de internalización de las SLP de diferentes cepas de L. kefiri empleando BMDCs provenientes de ratones deficientes en los receptores Mincle y SignR3, observamos que la internalización de las glicoproteínas SLP-8348 y SLP-8321 es dependiente de Mincle, mientras que SignR3 es el receptor que media la internalización de la SLP-5818. En este sentido, la interacción de la SLP-5818 con el receptor DC-SIGN (ortólogo humano del SignR3) ha reportada por otros investigadores (Prado Acosta et al. 2016). Estos resultados son coherentes con los análisis de la estructura de los glicanos presentes en dichas SLP, ya que la SLP-8348 y la SLP- 8321 presentan los mismos restos glicosídicos, mientras que existen algunas diferencias con la SLP 5818 que podrían explicar estos resultados (Malamud et al. 2020). La internalización de SLP por células dendríticas fue reportada recientemente para la SlpA de L. helveticus MIMLh5, aunque no se ha determinado el o los receptores implicados en dicho proceso (Taverniti et al. 2019).
Dado que diferentes RRP, como los TLR y los CLR, comparten vías de señalización intracelular, el reconocimiento de ligandos por ambos tipos de receptores puede potenciar, inhibir o modular la respuesta inmune (Thaiss et al. 2016). En nuestro caso, todas las SLP estudiadas fueron capaces de activar las BMDCs y potenciar maduración inducida por LPS. Estos resultados concuerdan parcialmente con los obtenidos empleando la línea de macrófagos murinos Raw264.7, sobre las cuales las SLP de L. kefiri no fueron capaces de inducir activación por sí solas. Al emplear las BMDCs provenientes de ratones deficientes en los receptores Mincle y SignR3, y en concordancia con los resultados obtenidos en los ensayos de internalización, observamos que tanto la SLP-8348 como la SLP-8321 requieren de la presencia de Mincle para ejercer su efecto inmunoestimulatorio, mientras que SignR3 es el receptor que media la acción de la SLP-5818. En este sentido, otros investigadores han demostrado que el reconocimiento de la SlpA de L. acidophilus NCFM por el receptor DC-SIGN genera una modulación de la respuesta al LPS en un modelo de células dendríticas inmaduras (Konstantinov et al. 2008). Por otro lado, diversos estudios han demostrado que el reconocimiento de ligandos vía Mincle, tales como el glicopéptido micobacteriano TDM y un glicolípido sintético análogo al GL1 de L. plantarum, conduce a la activación celular (Schoenen et al. 2010, Shah et al. 2016). Sin embargo, la participación de estos receptores en la internalización de las SLP y en su capacidad de activar células presentadoras de antígeno no había sido reportada anteriormente.
Dado que también observamos que el efecto estimulador de las SLP sobre las BMDCs redundaba en una mayor activación de células T CD4+, seleccionamos la SLP-8348 para evaluar su inmunogenicidad y capacidad adyuvante en ensayos in vivo. En este sentido, demostramos que la SLP-8348 es inmunogénica y es capaz de potenciar la respuesta inmune específica frente a un antígeno modelo (OVA). Los ensayos realizados con la glicoproteína sometida a la oxidación de sus carbohidratos terminales indicaron que ambas propiedades son dependientes de la integridad de los glicanos. El rol de los glicanos en la inmunogenicidad de glicoproteínas bacterianas ha sido también reportado por otros autores (Horn et al. 1999, Kajikawa et al. 2015). Por otro lado, estudios anteriores han demostrado la capacidad adyuvante de SLP provenientes de lactobacilos, como es el caso de la SlpB de L. buchneri, sin embargo, y a pesar de tratarse también de una glicoproteína, el papel que los azúcares podrían cumplir en dicho efecto no fue estudiado por los investigadores (Anzengruber et al. 2017).
La capacidad de las SLP de autoensamblarse formando arreglos bidimensionales ha dificultado enormemente la posibilidad de cristalizar estás proteínas. Existen algunos reportes de la cristalización de fragmentos pequeños de SLP (Fagan et al. 2009) y de SLP enteras, pero en este último caso, utilizando nano-anticuerpos como chaperonas (Baranova et al. 2012). De hecho, en nuestro caso intentamos cristalizar la SLP-8348 para realizar estudios de difracción de rayos X, pero no tuvimos éxito. Las imágenes TEM muestran claramente que la SLP-8348 forma arreglos hexagonales (p6) regulares. Este ordenamiento bidimensional nos ha permitido, en el marco de otros proyectos interdisciplinarios, utilizar esta glicoproteína como soporte para la síntesis de nanopartículas de Ag y Pt con excelente capacidad catalítica (bionanocatalizadores) (Bolla et al. 2020a, b).
Conclusiones
Durante el desarrollo del proyecto pudimos probar que las SLP provenientes de tres cepas de L. kefiri son capaces de activar células presentadoras de antígeno y potenciar la activación inducida por LPS a través del reconocimiento vía CLR, lo que redunda en una mayor capacidad para estimular LTCD4+ antígeno-específicos. Las SLP-8321 y SLP-8348 ejercen su efecto vía Mincle, mientras que la SLP-5818 lo hace a través de SignR3. Asimismo, estudios in vivo permitieron demostrar la importancia de la integridad de los glicanos en la inmunogenicidad y en la capacidad adyuvante de la SLP-8348, la cual adopta una geometría hexagonal al auto-ensamblarse en solución.
Por lo tanto, las SLP de L. kefiri emergen como herramientas valiosas para el desarrollo nuevos adyuvantes vacunales provenientes de bacterias seguras.
Referencias bibliográficas
- Anzengruber J, Bublin M, Bönisch E, Janesch B, Tscheppe A, Braun ML, Varga EM, Hafner C, BreitenederH, Schäffer C. Lactobacillus buchneri S-layer as a carrier for an Ara h 2-derived peptide for peanut allergen- specific immunotherapy. 2017 Mol Immunol 85: 81-7.
- Baranova E, Fronzes R, Garcia-Pino A, Van Gerven N, Papapostolou D, Péhau-Arnaudet G, Pardon E, Steyaert J, Howorka S, Remaut H. SbsB structure and lattice reconstruction unveil Ca2+ triggered S-layer assembly. 2012 Nature 487: 119-22.
- Bolla PA, Huggias S, Serradell MA, Ruggera JF, Casella ML. Synthesis and catalytic application of silver nanoparticles supported on Lactobacillus kefiri S-layer proteins. 2020b Nanomaterials (Basel) 10: 2322.
- Bolla PA, Sanz A, Huggias S, Ruggera JF, Serradell MA, Casella ML. Regular arrangement of Pt nanoparticles on S-layer proteins isolated from Lactobacillus kefiri: synthesis and catalytic application. 2020a Mol Catalysis 481: 110262.
- Carasi P, Díaz M, Racedo SM, De Antoni GL, Urdaci MC, Serradell MA. Safety characterization and antimicrobial properties of kefir-isolated Lactobacillus kefiri. 2014 Biomed Res Int 2014:208974.
- Carasi P. Potencialidad probiótica de lactobacilos con capa S. Estudios sobre la inocuidad, efecto antimicrobiano y capacidad inmunomodulatoria de Lactobacillus kefiri. 2014 Tesis Doctoral, Universidad Nacional de La Plata.
- Cavallero G, Malamud M, Casabuono AC, Serradell MA, Couto AS. A glycoproteomic approach reveals that the S-layer glycoprotein of Lactobacillus kefiri CIDCA 83111 is O- and N-glycosylated. 2017 J Proteomics 162: 20-9.
- Chinthamani S, Settem RP, Honma K, Kay JG, Sharma A. Macrophage inducible C-type lectin (Mincle) recognizes glycosylated surface (S)- layer of the periodontal pathogen Tannerella forsythia. 2017 PLoS ONE 12: e0173394.
- Claus H, Akça E, Debaerdemaeker T, Evrard C, Declercq JP, Harris JR, Schlott B, König H. Molecular organization of selected S-layer proteins. 2005 Can J Microbiol 51: 731-43.
- Fagan RP, Albesa-Jove D, Qazi O, Svergun DI, Brown KA, Fairweather NF. Structural insights into the molecular organization of the S-layer from Clostridium difficile. 2009 Mol Microbiol 71:1308–22.
- Farjadian F, Moghoofei M, Mirkiani S, Ghasemi A, Rabiee N, Hadifar S, Beyzavi A, Karimi M, Hamblin MR. Bacterial components as naturally inspired nano-carriers for drug/gene delivery and immunization: set the bugs to work? 2018 Biotechnol Adv S0734-9750(18)30038-7.
- Garrote G, Delfederico L, Bibiloni R, Abraham AG, Pérez P, Semorile L, De Antoni GL. Heterofermentative lactobacilli isolated from kefir grains: evidence for the presence of S-layer proteins. 2004 J Dairy Res 71: 222- 30.
- Gerbino E, Carasi P, Mobili P, Serradell MA, Gómez-Zavaglia A. role of S-layer proteins in bacteria. 2015 World J Microbiol Biotechnol 31: 583-92.
- Horn C, Namane A, Pescher P, Riviere M, Romain F, Puzo G, Barzu O, Marchal G. Decreased capacity of recombinant 45/47-kDa molecules (Apa) of Mycobacterium tuberculosis to stimulate T lymphocyte responses related to changes in their mannosylation pattern. 1999 J Biol Chem 274: 32023–30.
- Ilk N, Schumi CT, Bohle B, Egelseer EM, Sleytr UB. Expression of an endotoxin-free S-layer/allergen fusion protein in gram-positive Bacillus subtilis 1012 for the potential application as vaccines for immunotherapy of atopic allergy. 2011 Curr Opin Biotechnol 22: 824-31.
- Kajikawa A, Zhang L, LaVoy A, Bumgardner S, Klaenhammer TR, Dean GA. Mucosal immunogenicity of genetically modified Lactobacillus acidophilus expressing an HIV-1 epitope within the surface layer protein. 2015 PLoS ONE 10: e0141713.
- Konstantinov SR, Smidt H, de Vos WM, Bruijns SC, Singh SK, Valence F, Molle D, Lortal S, Altermann E, Klaenhammer TR, et al. S layer protein A of Lactobacillus acidophilus NCFM regulates immature dendritic cell and T cell functions. 2008 Proc Natl Acad Sci USA 105: 19474–9.
- Lightfoot YL, Selle K, Yang T, Goh YJ, Sahay B, Zadeh M, Owen JL, Colliou N, Li E, Johannssen T, et al. SIGNR3-dependent immune regulation by Lactobacillus acidophilus surface layer protein A in colitis. 2015 EMBO J 34: 881–95.
- Malamud M, Bolla PA, Carasi P, Gerbino E, Gómez-Zavaglia A, Mobili P, Serradell MA. S-layer proteins from lactobacilli: biogenesis, structure, functionality and biotechnological applications. Chapter 6 in “Lactobacillus Molecular Biology: Genomics and Metabolic Engineering”, Ed. Sandra Ruzal, Caister Academic Press; ISBN: 978-1-910190-89-0. 2019a; pp 105-30.
- Malamud M, Carasi P, Assandri MH, Freire T, Lepenies B, Serradell MLÁ. S-layer glycoprotein from Lactobacillus kefiri exerts its immunostimulatory activity through glycan recognition by Mincle. 2019b Front Immunol 10: 1422.
- Malamud M, Carasi P, Bronsoms S, Trejo SA, Serradell MA. Lactobacillus kefiri shows inter-strains variations in the amino acid sequence of the S-layer proteins. 2017 Antonie van Leeuwenhoek 110: 515-30.
- Malamud M, Carasi P, Freire T, Serradell MA. S-layer glycoprotein from Lactobacillus kefiri CIDCA 8348 enhances macrophages response to LPS in a Ca+2-dependent manner. 2018 Biochem Biophy Res Comm 495: 1227-32.
- Malamud M, Cavallero GJ, Casabuono AC, Lepenies B, Serradell MLÁ, Couto AS. Immunostimulation by Lactobacillus kefiri S-layer proteins with distinct glycosylation patterns requires different lectin partners. 2020 J Biol Chem 295: 14430-44.
- Mobili P, Serradell MA, Trejo S, Avilés Puigvert FX, Abraham AG, De Antoni GL. Heterogeneity of S-layer proteins from aggregating and non-aggregating Lactobacillus kefir strains. 2009a Antonie van Leeuwenhoek 95: 363- 72.
- Prado Acosta M, Ruzal SM, Cordo SM. S-layer proteins from Lactobacillus sp. Inhibit bacterial infection by blockage of DC-SIGN cell receptor. 2016 Int J Biol Macromol 92: 998-1005.
- Raff J, Matys S, Suhr M, Vogel M, Günther T, Pollmann K. S-layer based nanocomposites for industrial applications. Chapter in “Protein-based Engineered Nanostructures, Advances in Experimental Medicine and Biology 940”, Ed. A.L. Cortajarena & T.Z. Grove, Springer International Publishing Switzerland; ISBN 978-3- 319-39194-6. 2016; pp 245-79.
- Rodríguez E, Noya V, Cervi L, Chiribao ML, Brossard N, Chiale C, et al. Glycans from Fasciola hepatica modulate the host immune response and TLR-induced maturation of dendritic cells. 2015 PLoS Negl Trop Dis 9: e0004234.
- Sancho D,Reis e Sousa C. Signaling by myeloid C-type lectin receptors in immunity and homeostasis. 2012 Annu Rev Immunol 30: 491-529.
- Schoenen H, Bodendorfer B, Hitchens K, Manzanero S, Werninghaus K, Nimmerjahn F, et al. Cutting edge: Mincle is essential for recognition and adjuvanticity of the mycobacterial cord factor and its synthetic analog trehalose-dibehenate. 2010 J Immunol 184: 2756–60.
- Schuster B, Sleytr UB. Nanotechnology with S-layer proteins. 2020 Methods Mol Biol 2073: 195-218.
- Shah S, Nagata M, Yamasaki S, Williams SJ. Total synthesis of a cyclopropane-fatty acid α-glucosyl diglyceride from Lactobacillus plantarum and identification of its ability to signal through Mincle. 2016 Chem Commun 52: 10902-5.
- Sleytr UB, Schuster B, Egelseer EM, Pum D. S-layers: principles and applications. 2014 FEMS Microbiol Rev 38: 823–64.
- Taverniti V, Marengo M, Fuglsang E, Skovsted HM, Arioli S, Mantegazza G, Gargari G, Iametti S, Bonomi F, Guglielmetti S, Frøkiær H. Surface layer of Lactobacillus helveticus MIMLh5 promotes endocytosis by dendritic cells. 2019 Appl Environ Microbiol 85: e00138-19.
- Taverniti V, Stuknyte M, Minuzzo M, Arioli S, De Noni I, Scabiosi C, Cordova ZM, Junttila I, Hamalainen S, Turpeinen H, et al. S-layer protein mediates the stimulatory effect of Lactobacillus helveticus MIMLh5 on innate immunity. 2013 Appl Environ Microbiol 79: 1221–31.
- Thaiss C, Levy M, Itav S, Elinav E. Integration of innate immune signaling. 2016 Trends Immunol 37: 84-101.
- Wang XY, Wang DB, Zhang ZP, Bi LJ, Zhang JB, Ding W, Zhang XE. A S-layer protein of Bacillus anthracis as a building block for functional protein arrays by in vitro self-assembly. 2015 Small 11: 5826-32.
- Zubiría MG, Gambaro SE, Rey MA, Carasi P, Serradell MA, Giovambattista A. Deleterious metabolic effects of high fructose intake: the preventive effect of Lactobacillus kefiri administration. 2017 Nutrients 9, 470.
Notas:
[1] Centro de Investigación y Desarrollo en Ciencias Aplicadas “Dr. Jorge J. Ronco” – CINDECA (UNLP-CONICET CCT La Plata), Calle 47 N° 257 (1900) La Plata/ b) Instituto de Ciencias de la Salud, Universidad Nacional Arturo Jauretche (ICS-UNAJ), Av. Calchaquí N° 6200 (1888), Florencio Varela.
[2] Cátedra de Microbiología, Departamento de Ciencias Biológicas, Facultad de Ciencias Exactas, UNLP, Calle 47 y 115 s/n (1900), La Plata/ Medical Research Council Centre for Medical Mycology, University of Exeter, Exeter, United Kingdom.
[3] Centro de Investigación y Desarrollo en Ciencias Aplicadas “Dr. Jorge J. Ronco” – CINDECA (UNLP-CONICET CCT La Plata), Calle 47 N° 257 (1900) La Plata/ Instituto de Ciencias de la Salud, Universidad Nacional Arturo Jauretche (ICS-UNAJ), Av. Calchaquí N° 6200 (1888), Florencio Varela
[4] Instituto de Ciencias de la Salud, Universidad Nacional Arturo Jauretche (ICS-UNAJ), Av. Calchaquí N° 6200 (1888), Florencio Varela/ Cátedra de Microbiología, Departamento de Ciencias Biológicas, Facultad de Ciencias Exactas, UNLP, Calle 47 y 115 s/n (1900), La Plata.
