GNAS and KRAS test in the diagnosis of pancreatic cysts
Carolina Ramírez[1]
Hui Her Huang
Instituto de Ciencias de la Salud, Universidad Nacional Arturo Jauretche
Resumen
Aunque muchos quistes, como pseudoquistes y quistadenomas serosos (SCA), tienen un curso clínico benigno, otros, como neoplasmas mucinosos papilares intraductales (IPMN) y neoplasmas quísticos mucinosos (MCN), representan lesiones precursoras del adenocarcinoma pancreático invasivo. La neoplasia mucinosa papilar intraductal del páncreas se caracteriza por una dilatación del conducto pancreático principal y / o los conductos secundarios, producción de mucina y ausencia de estroma de tipo ovárico. Los síntomas son inespecíficos y, en general, el diagnóstico es incidental. Debido a su riesgo de malignidad, se desarrollaron guías de consenso internacional para la gestión de IPMN y MCN y se actualizaron recientemente. Estas pautas de manejo se basan en la suposición de que los quistes mucinosos se pueden distinguir con precisión de otras lesiones quísticas pancreáticas.A pesar de estas medidas, la distinción preoperatoria de quistes pancreáticos entre sí es dificil y, si es incorrecta, puede representar un riesgo significativo para la salud del paciente. Estas pautas de manejo recomiendan el análisis del líquido del quiste en aquellos centros con experiencia en ultrasonido endoscópico y aspiración con aguja fina (EUS-FNA) e interpretación citológica. El objetivo de este proyecto es analizar las características moleculares de los quistes pancreáticos utilizando el líquido pancreático obtenido por aspiración en pacientes del Hospital El Cruce para poder identificar marcadores genéticos pronósticos que ayuden a los médicos en la toma de decisiones.
Palabras claves: marcadores genéticos, cáncer pancreático, quistes
Abstract
Although many cysts, such as pseudocysts and serous cystadenomas (SCA), have a benign clinical course, others, such as intraductal papillary mucinous neoplasms (IPMN) and mucinous cystic neoplasms (MCN), represent precursor lesions of invasive pancreatic adenocarcinoma.Intraductal papillary mucinous papillary neoplasia of the pancreas is characterized by dilatation of the main pancreatic duct and / or secondary ducts, production of mucin and absence of ovarian-type stroma.
The symptoms are non-specific and, in general, the diagnosis is incidental. Because of its risk of malignancy, an international consensus guide for the management of IPMN and MCN has been developed and updated recently.These management guidelines are based on the assumption that mucinous cysts can be accurately distinguished from other pancreatic cystic lesions.Despite these measures, the preoperative distinction of pancreatic cysts from each other is difficult and if it is incorrect, it may represent a significant risk to the patient’s health. These management guidelines allowed the analysis of cyst fluid in centers with experience in endoscopic ultrasound and fine needle aspiration (EUS-FNA) and cytological interpretation.The objective of this project is to analyze the molecular characteristics of pancreatic cysts using pancreatic fluid obtained by aspiration in patients from Hospital El Cruce in order to identify prognostic genetic markers that help physicians make decisions.
Keywords: genetic markers, pancreatic cáncer, cysts
Introducción
Como consecuencia de la utilización de métodos por imágenes con mayor resolución, como la tomografía computada (TC) y la resonancia magnética nuclear (RMN), se ha incrementado la detección incidental de quistes pancreáticos entre el 2 y 13 %.11,12
Existen muchos tipos de quistes pancreáticos. Las lesiones quísticas del páncreas pueden ser inflamatorias o proliferativas4. Diferenciar entre tumores premalignos de bajo y alto riesgo es difícil y las consecuencias de perder la oportunidad de una resección curativa en los pacientes adecuados pueden ser devastadoras.
Para prevenir esto, muchos centros recomiendan la escisión de rutina de todos los tumores quísticos pancreáticos (PCT) sospechosos, exponiendo potencialmente a los pacientes con enfermedad benigna a los riesgos injustificables de una cirugía mayor. Los PCT pueden clasificarse en tumores no mucinosos con potencial maligno insignificante, como los cistoadenomas serosos (SCA) y aquellos con potencial maligno significativo, como neoplasias mucinosas papilares intraductales (IPMN) y neoplasias quísticas mucinosas (MCN). Los quistes mucinosos tienen el potencial de dar lugar a carcinoma in situ o invasivo, a través de una secuencia de progresión hacia adenomacarcinoma. Por lo tanto, la evaluación de un PCT y un correcto diagnóstico preoperatorio es crucial para la toma de decisiones clínicas2.
La neoplasia papilar mucinosa intraductal del páncreas (IPMN) es un tumor epitelial en forma de masa quística que consiste en la dilatación de conductos recubiertos por células neoplásicas que presentan un patrón de crecimiento papilar y segrega abundante mucina. Es distinto del adenocarcinoma pancreático ductal, un tipo convencional de cáncer de páncreas que generalmente forma una masa sólida y mal definida. IPMN es la segunda neoplasia exocrina pancreática más común y se estima que representa el 5% de los casos quirúrgicos de neoplasias pancreáticas4.
No existe un cuadro clínico característico y la mayoría de los enfermos consultan por síntomas inespecíficos. Por esto, el diagnóstico habitualmente se realiza en forma incidental con estudios imagenológicos del abdomen1.
El tratamiento, en general, es quirúrgico. Esta conducta se basa en diferentes estudios que muestran una progresión desde adenoma a adenocarcinoma1.
La operación depende de la localización y extensión de la enfermedad y el pronóstico de los pacientes depende fundamentalmente de la naturaleza de la lesión, siendo peor en los tumores invasores.
También los pacientes con un tumor maligno derivado de una IPMN tienen mejor pronóstico que los con un adenocarcinoma pancreático clásico3.
Los pacientes con IPMN pueden experimentar sintomatología tipo pancreatitis crónica o aguda por obstrucción de los conductos debido al exceso de mucina producida, resultando en destrucción acinar y atrofia, ictericia debido a la invasión del conducto biliar o diseminación y metástasis hepática. La IPMN puede presentarse como un tumor no invasivo con diferentes grados de atipia o como un tumor avanzado asociado a carcinoma invasivo4.
El principal diagnóstico diferencial es la neoplasia mucosa quística del páncreas (NQM), de la que se diferencia porque carece de estroma de tipo ovárico, existe comunicación de la dilatación quística con los conductos del páncreas, no presenta pseudocápsula y puede existir compromiso multifocal. Esta distinción es muy importante ya que constituye un factor pronóstico3.
Dependiendo de las características de las células que revisten los conductos, las IPMNs se pueden dividir en: IPMN de tipo gástrico: Las células que revisten las papilas o la dilatación quística son cilíndricas altas, con abundante mucina apical, semejante a las células foveolares gástricas. IPMN de tipo intestinal: posee papilas largas, villiformes, paralelas, con células que contienen menor cantidad de mucina, pseudoestratificadas y de núcleos alargados, a veces con células caliciformes. IPMN de tipo pancreatobiliar: con papilas complejas revestidas por células cuboideas, de núcleos redondos, que recuerdan las neoplasias papilares de los conductos biliares. Es importante destacar que en una IPMN puede haber una mezcla de estos tres tipos. Existen además otros dos tipos de neoplasia intraductal pancreática que representan variantes de la IPMN: la neoplasia papilar intraductal oncocítica (NPIO) y la neoplasia intraductal tubular (NIT)3.
El pronóstico para los pacientes con IPMN asociado a carcinoma invasivo es de 27-60% de sobrevida a 5 años, dependiendo de la extensión y el tipo histológico del componente invasivo. Aunque estas características distintivas y únicas son conocidas, los mecanismos moleculares de desarrollo y progresión de IPMN aún no están del todo caracterizados lo cual impide el desarrollo de marcadores moleculares o drogas dirigidas de utilidad para la prevención, diagnóstico temprano y cura de esta enfermedad4.
En trabajos que estudiaron alteraciones moleculares en las IPMN se ha demostrado que estas neoplasias con frecuencia portan mutaciones somáticas en el gen GNAS, que no están presentes en adenocarcinomas ductales pancreáticos ni otras neoplasias quísticas del páncreas.
Estas mutaciones activantes recurrentes en el codón 201 de GNAS, resultan principalmente en un cambio en la proteína de R201H o R201C, están presentes tanto en neoplasias de alto y bajo grado y también se suelen hallar en pequeños IPMNs incipientes2,7,8,9.
El gen GNAS se encuentra en el brazo largo del cromosoma 20 (20q13.3) y codifica para la proteína Gsα de la proteína de señalización Gs. Las proteínas G son transductores de señales que median la unión del receptor de ligandos a los sistemas mensajeros intracelulares. La activación de la adenilato ciclasa, una liasa que cataliza la conversión de ATP a cAMP, está bajo control de la estimulación de Gs y de la inhibición de Gi. El cAMP se une a la protein-kinasa A dependiente de cAMP, activandola y en consecuencia a la corriente descendente de cascadas de señalización.
Estas mutaciones, principalmente R201H y R201C, interrumpen la actividad hidrolítica que intercambia la unión guanosina trifosfato a guanosina difosfato y de esta manera inactiva Gsα. Dicha disrupción resulta en una activación constitutiva de Gsα y por lo tanto de la cascada de señalización downstream5, 9.
Se ha demostrado que las mutaciones en GNAS actúan de forma cooperativa con las ya conocidas mutaciones del gen KRAS (codones 12 y 13) en el desarrollo tumoral del páncreas4.
Las mutaciones en GNAS se encuentran en IPMNs tipo intestinal (78%) seguidas de IPMNs tipo gástrico (62%) en tanto que las mutaciones en KRAS se encuentran principalmente en IPMNs tipo gástrico (80%) y adenocarcinomas pancreáticos (100%)2,8. Los IPMNs son los únicos tumores con mutación de ambos, KRAS y GNAS, es por esto que el análisis molecular del contenido de los quistes pancreáticos es promisorio para establecer biomarcadores de malignidad apropiados.También se sabe que existen al menos 14 miRNAs asociados a IPMNs2.
Actualmente se necesita estratificar el diagnóstico de quistes pancreáticos por su riesgo de malignidad, para planificar la resección quirúrgica3.
Para ello se necesita un diagnóstico integrado que incluya aspectos moleculares, citológicos y radiológicos-imagenológicos, por ahora la citología y bioquímica solas no son capaces de subclasificar lesiones mucosas quísticas3, 6.
En este proyecto se plantea realizar una caracterización molecular de la población de pacientes con lesiones pancreáticas que son tratados en el Hospital el Cruce- HNK (HEC) utilizando el líquido pancreático obtenido por aspiración en el Servicio de Gastroenterología. De manera que constituya una primera etapa en la búsqueda de marcadores moleculares y posterior desarrollo de herramientas diagnósticas que ayuden al profesional de la salud a tomar decisiones quirúrgicas con mayor certeza y más beneficiosas para el paciente.
Metodología:
Las muestras de líquido pancreático se obtendrán por aspiración con aguja fina mediante eco- endoscopía en el servicio de Gastroenterología del HEC. Seguidamente se realizará la extracción de ADN genómico a partir de 200 ul de fluido quístico utilizando el kit QiaAmp DNA mini kit (Qiagen) y se cuantificará por espectrofotometría.
Se amplificarán las regiones específicas por PCR y luego las mutaciones serán detectadas por secuenciación y análisis de electroferogramas6, 7.
Resultados
Se recolectaron muestras de 8 pacientes con quistes pancreáticos: para cada caso se tomó muestra de líquido de quistes pancreáticos (LQ), biopsia de las paredes quísticas con una micropinza Moray® y sangre periférica.Las muestras de LQ y biopsia se almacenaron a -20°C hasta realizar la extracción de ADN.
A partir de la muestra de sangre periférica se separó plasma y se guardó a -80°C, también se guardó buffy coat (células de la capa leucocitaria). Ambos tipos de muestras se guardaron en el Biobanco del CEMET con el fin complementar los resultados obtenidos. Para ello a cada paciente se le impartió el consentimiento informado aprobado por el Comité de Ética del Hospital el Cruce (HEC).
Se estandarizó la extracción de ADN genómico de LQ y biopsia de pared usando el kit QIAamp® de Qiagen, obteniendo concentraciones aceptables (entre 15 y 30 µg/ml) para las técnicas de amplificación que se realizaron downstream.
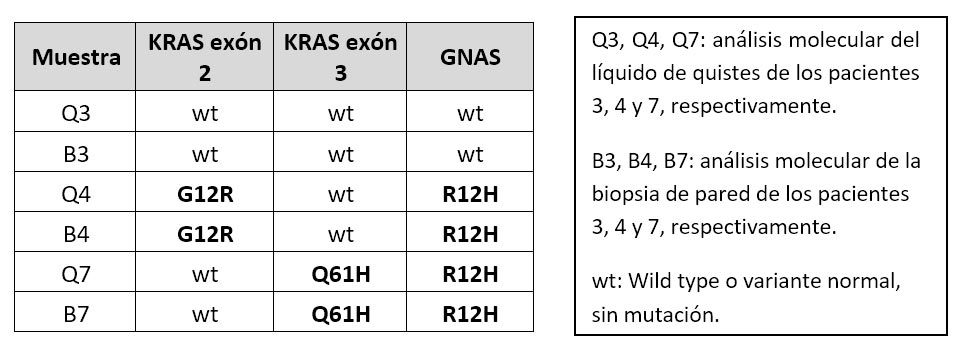
Para analizar el estado mutacional de los genes kras y gnas, se amplificaron 3 regiones génicas, 2 que contienen a los codones 12 y 13 en el exón 2 y al codón 61 en el exon 3 del gen kras. Y también se amplifico la región que contiene al codón 208 que se encuentra en el exón 4 del gen gnas.
Se realizó la puesta a punto de las 3 reacciones de amplificación por PCR de punto final alcanzando resultados óptimos para luego secuenciar (fig. 1).
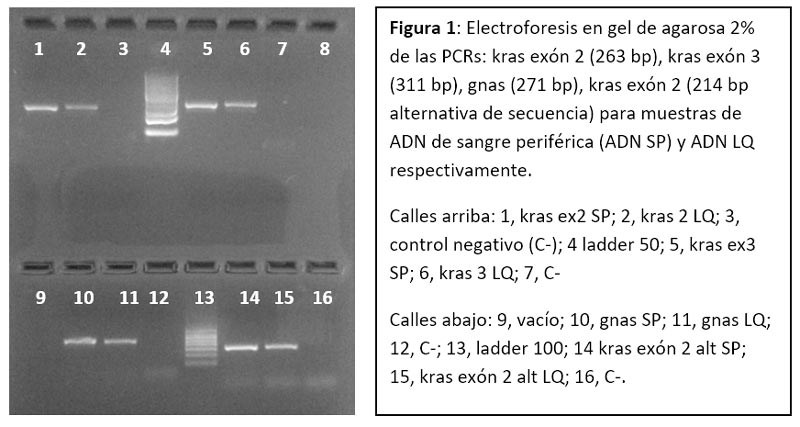
Análisis molecular KRAS y GNAS.
Se realizó extracción de ADN de las muestras del líquido (Q) y tejido de la pared (B) de quistes pancreáticos de 3 pacientes (número 3, 4 y 7): Q3, Q4 y Q7 corresponden al análisis del líquido, y B3, B4 y B7 corresponden al estudio del tejido. Se amplificaron 3 regiones específicas por PCR y se secuenciaron por el método de Sanger.
Las secuencias obtenidas se compararon con una secuencia de referencia, es decir, que no presenta mutaciones en las posiciones estudiadas, utilizando un software específico.
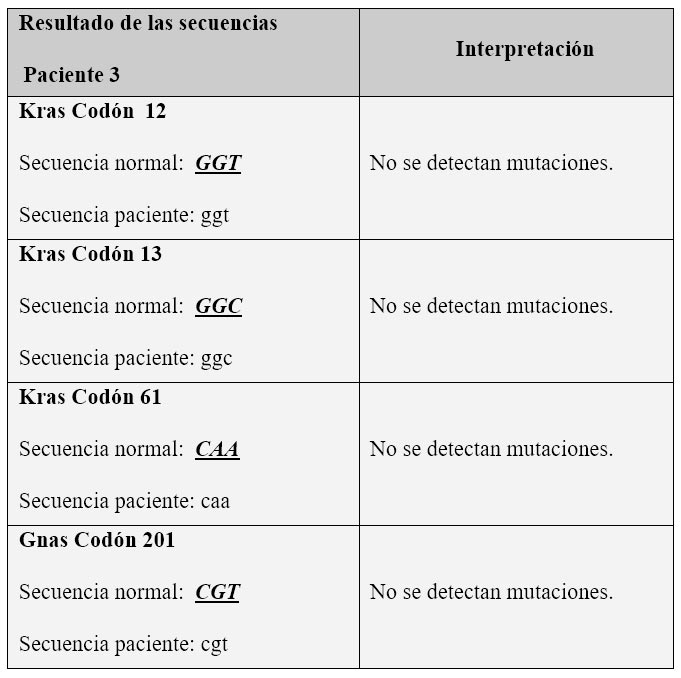
Resultados del análisis molecular del paciente 3.
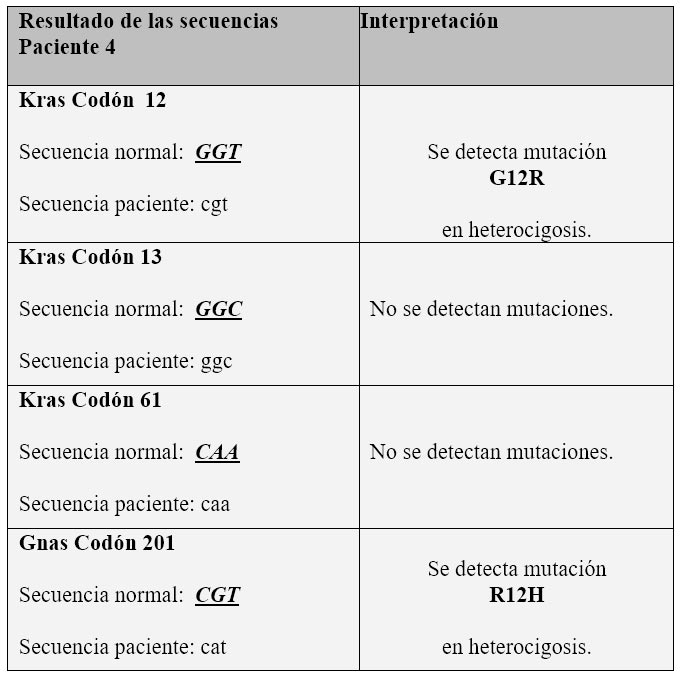
Resultados del análisis molecular del paciente 4.
Cromatograma del paciente 4. Secuencias de GNAS, mutación R201H (CGT → CAT). La amplitud del pico verde, que representa la presencia del nucleótido A en la posición del G, es menor en la muestra de líquido de quiste con respecto a la muestra de biopsia de la pared marcada con la línea negra.
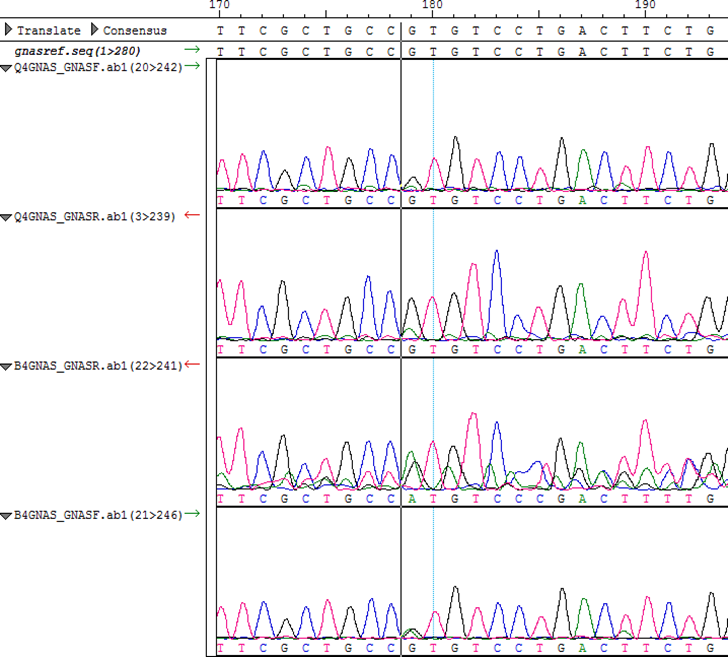
La amplitud del pico azul, que representa la presencia del nucleótido C en la posición de G, es menor en la muestra de líquido de quiste con respecto a la muestra de biopsia marcada con la línea negra.
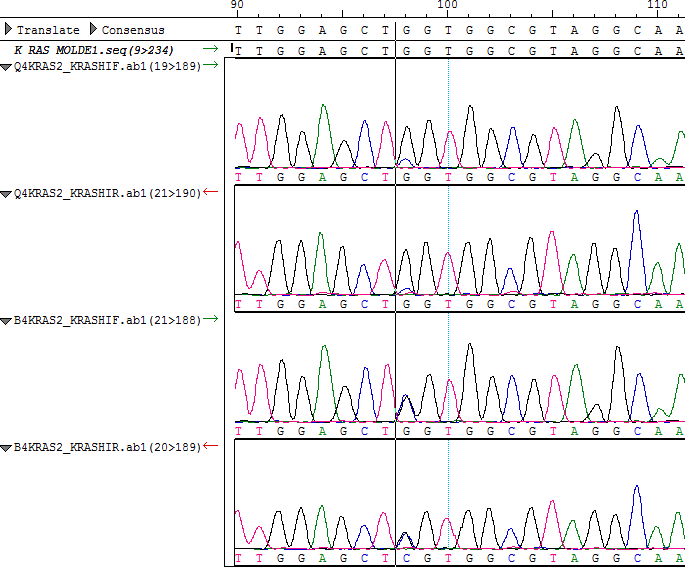
Resultados del análisis molecular del paciente 7.
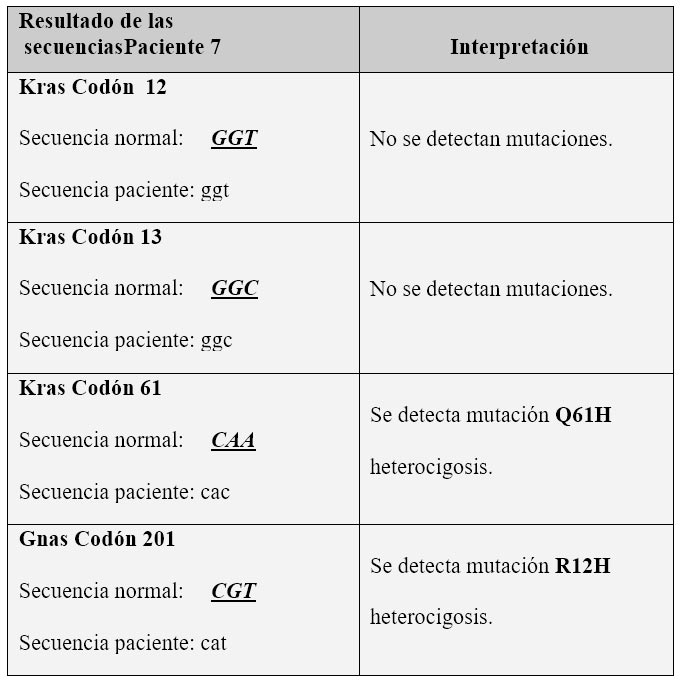
Cromatogramas del paciente 7: Secuencias de GNAS con mutación R201H (CGT → CAT) marcada con la línea negra.
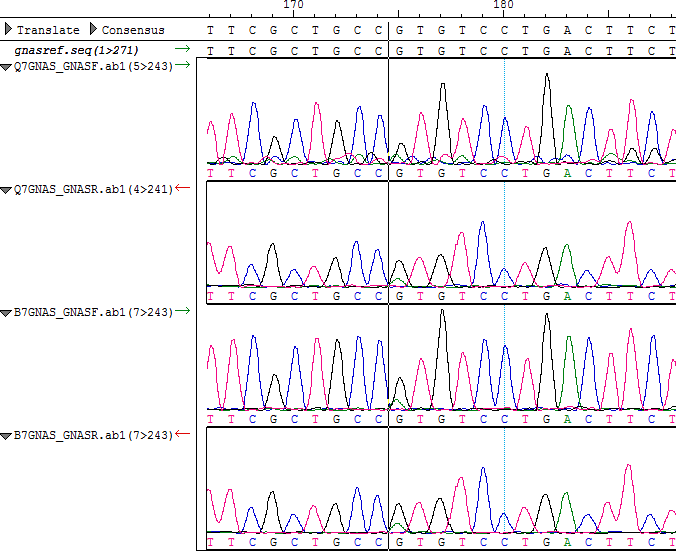
Cromatogramas del paciente 7: Secuencias de KRAS con mutación Q61H (CAA → CAC). La amplitud del pico azul, que representa la presencia del nucleótido C en la posición de A, es menor en la muestra de líquido de quiste con respecto a la muestra de biopsia marcada con la línea negra.
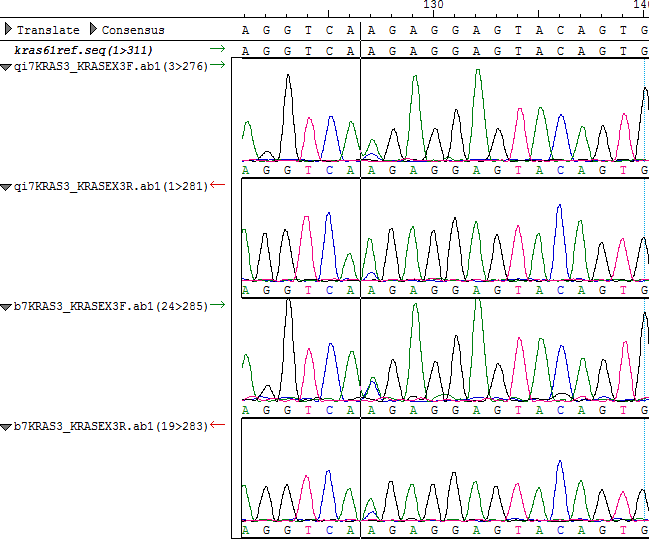
Tabla 1. Resumen de los resultados del análisis molecular KRAS y GNAS de los pacientes 3, 4 y 7.
Se realizó la amplificación de todas las regiones a secuenciar en los 8 pacientes reclutados, pero por cuestiones de presupuesto se enviaron a secuenciar las muestras de 3 pacientes.
Aunque sólo se hizo el análisis molecular en 3 pacientes, en dos se detectaron mutaciones de los genes KRAS y GNAS confirmando el diagnóstico de tumor quístico mucinoso y TMPI tipo II.
El tercer paciente, se pudo confirmar que portaba una lesión benigna gracias a la tipificación molecular.
Durante el desarrollo, el proyecto se vio interrumpido el reclutamiento de pacientes ya que se redujeron al mínimo las solicitudes de ecoendoscopías en el servicio de Gastroenterología del Hospital el Cruce. Por otra parte la cotización tan volátil del dólar también tuvo un fuerte impacto en la proyección de las actividades ya que los insumos médicos y de biología molecular se presupuestan en esa moneda.
Recomendaciones o Discusión
El diagnóstico de los quistes de páncreas es complejo y constituye un desafío clínico, como consecuencia de la falta de un método de diagnóstico estándar. Alcanzar un diagnóstico preciso es muy importante porque algunas lesiones presentan alto riesgo de evolucionar a adenocarcinoma (como el cistoadenoma mucinoso y el TMPI). También se pueden presentar lesiones que finalmente son tumores malignos con degeneración quística como el adenocarcinoma con necrosis y el tumor neuroendócrino quístico.
Dado que no existe un método con 100 % de sensibilidad y especificidad, y no todos los quistes tienen indicación quirúrgica, el diagnóstico debe apoyarse en múltiples estudios que generalmente se solicitan en forma escalonada de menor a mayor complejidad. Los estudios iniciales suelen ser la tomografía computada (TC) seguida por resonancia magnética nuclear (RMN).
Cuando con estas técnicas no se alcanza un diagnóstico se sigue con la USE. En algunas situaciones con sólo el aspecto morfológico se puede realizar el diagnóstico, sin embargo, existe mucha superposición en las características de estos quistes de manera que en muchos pacientes no se puede llegar a un diagnóstico certero. Por consiguiente, la ventaja de la USE es la posibilidad de punzar y aspirar el líquido para analizar posteriormente.
Aunque existen muchas limitaciones en la citología del líquido por ser acelular o hipocelular, el análisis de marcadores bioquímicos como el CEA, amilasa y glucosa pueden contribuir al diagnóstico.
Lo novedoso de nuestro trabajo es la determinación de mutaciones de los genes KRAS y GNAS tanto en el líquido aspirado como en el tejido de la pared quística biopsiada. La presencia de mutaciones de estos genes hace diagnóstico de los tumores quísticos mucinosos. Analizando los electroferogramas observamos que la señal de las mutaciones es más intensa en las muestras de biopsia que en el líquido de quiste. Esto sugiere que la sensibilidad de la determinación aumenta cuando se realiza la EUS-FNA con una pinza Moray, sin embargo, tanto en líquido como en biopsia de pared de quiste se pueden detectar las mutaciones.
Referencias bibliográficas:
- Abdurrahman Kadayifci, Mustafa Atar, Jessica L. Wang, David G. Forcione, Brenna W. Casey, Martha Pitman and William R. Brugge (2017) Value of adding GNAS testing to pancreatic cyst fluid KRAS and carcinoembryonic antigen analysis for the diagnosis of intraductal papillary mucinous neoplasms. Digestive Endoscopy; 29: 111–117
- Adam E Frampton, Justin Stebbing, Tamara MH Gall, Benjamin Silver, Long R Jiao & Jonathan Krell (2015) Activating mutations of GNAS and KRAS in cystic fluid can help detect intraductal papillary mucinous neoplasms of the pancreas. Expert Rev. Mol. Diagn. 15(3), 325–328
- Butte Jean M, Torres Javiera, O’Brien Andres, Jarufe Nicolas, Llanos Osvaldo. (2008) Neoplasia mucinosa intraductal del páncreas. Rev Med Chile; 136: 517-527.
- Garcea G, Ong SL, Rajesh A, et al. (2008) Cystic lesions of the pancreas. Pancreatology; 8(3):236-51
- Hanno Matthaei, Jian Wu, Marco dal Molin, Chanjuan Shi, Sven Perner, Glen Kristiansen, Philipp Lingohr, Jörg C. Kalff, Christopher L. Wolfgang, Kenneth W. Kinzler, Bert Vogelstein, Anirban Maitra, and Ralph H. Hruban. (2014) GNAS sequencing identifies IPMN-specific mutations in a subgroup of diminutive pancreatic cysts referred to as “incipient IPMNs”. Am J Surg Pathol;38(3):360-3
- K Taki, M Ohmuraya, E Tanji, H Komatsu, D Hashimoto, K Semba, K Araki, Y Kawaguchi, H Baba and T Furukawa (2016) GNASR201H and KrasG12D cooperate to promote murine pancreatic tumorigenesis recapitulating human intraductal papillary mucinous neoplasm. Oncogene;35, 2407-2412
- Nikiforova MN, Khalid A, Fasanella KE, McGrath KM, Brand RE, Chennat JS, et al. (2013) Integration of KRAS testing in the diagnosis of pancreatic cystic lesions: a clinical experience of 618 pancreatic cysts. Mod Pathol;26:1478–87
- Singhi AD, Nikiforova MN, Fasanella KE, McGrath KM, Pai RK, Ohori NP, Bartholow TL, Brand RE, Chennat JS, Lu X, Papachristou GI, Slivka A, Zeh HJ, Zureikat AH, Lee KK, Tsung A, Mantha GS, Khalid A (2014) Preoperative GNAS and KRAS testing in the diagnosis of pancreatic mucinous cysts. Clin Cancer Res 20:4381–4389
- Tan MC, Basturk O, Brannon AR, Bhanot U, Scott SN, Bouvier N, LaFemina J, Jarnagin WR, Berger MF, Klimstra D, Allen PJ (2015) GNAS and KRAS mutations define separate progression pathways in intraductal papillary mucinous neoplasm-associated carcinoma. J Am Coll Surg 220:845–854.
- Waki Hosoda, Eiichi Sasaki, Yoshiko Murakami, Kenji Yamao, Yasuhiro Shimizu, Yasushi Yatabe (2015) GNAS mutation is a frequent event in pancreatic intraductal papillary mucinous neoplasms and associated adenocarcinomas
- Laffan TA, Horton KM, Klein AP, et al. Prevalence of unsuspected pancreatic cysts on AJR Am J Roentgenol 2008;191:802–7.
- Lee KS, Sekhar A, Rofsky NM, et al. Prevalence of incidental pancreatic cysts in the adult population on MR imaging. Am J Gastroenterol 2010;105: 2079–84.
Notas:
[1] (carolinavramirez@gmail.com)
